|
Intestino
irritable: Fisiopatología
Dr.
César Soriano Alvarez (*)
Fisiopatología
Hasta hace poco tiempo los conocimientos no permitían
un concepto integrado de la fisiopatología del Síndrome
del Intestino Irritable (SII) o lo hacía menos comprensible. Sin
embargo, con el desarrollo de nuevas técnicas de estudio (Tomografía
con Emisión de positrones, Resonancia Magnética Funcional,
Magnetoencefalografía, Potenciales Evocados Somatosensoriales,
Planimetría por Impedancia, Barostato, conocimiento de neuromediadores
de la hipersensibilidad visceral, etc.) a la fecha se tiene una concepción
más clara de tan complejo síndrome.
Antes de la década
del setenta dominaba el concepto de las alteraciones de la función
motora en el SII. A partir de entonces, se incluye el concepto de hipersensibilidad
visceral; posteriormente se agregan
los conocimientos de la interacción del eje cerebro-intestino
y últimamente se reconoce el rol de la 5-Hidroxitriptamina (5-HT)
como mediador hormonal de la motilidad gastrointestinal y de la hipersensibilidad
visceral (1, 2).
Por estas razones, hoy en día es ampliamente
aceptado y se encuentra bien fundamentado el concepto de que en la mayor
parte
de pacientes con
SSI existe una hipermotilidad intestinal asociada a hipersensibilidad
visceral junto a molestias y dolor de diversas intensidades como producto
de un incremento en la percepción de los eventos mecánicos
que ocurren en el tracto digestivo en comparación con los individuos
sanos.
A éstos se agregan los factores psicosociales interactuando
con ellos. Últimamente se asume que la disfunción podría
ser subsecuente a una gastroenteritis aguda, probablemente por una actividad
inflamatoria o inmunológica persistente y de bajo grado (3).
Bases
anátomo-fisiológicas
En el tubo digestivo el sistema nervioso autonómico
está representado
por los sistemas nerviosos parasimpático, simpático y el
sistema nervioso entérico (SNE).
Sistema nervioso entérico,
motilidad y neurotrasmisores
El SNE es considerado un sistema semiautónomo
encargado de controlar las funciones de motilidad y secreciones del intestino
(4). Su actividad
puede ser modificada por los sistemas nervioso parasimpático y
simpático pero, mantiene un nivel de independencia o autonomía
y una distribución "jerárquica " de sus funciones.
El
Dr. Gershon define al SNE como el "segundo cerebro" o cerebro
intestinal (5). El SNE estructuralmente y en su parte neuroquímica
actúa como un cerebro independiente, en el cual el conjunto de
microcircuitos que llevan neurotrasmisores y neuromoduladores actúan
independientemente o en su defecto, a través del sistema nervioso
periférico. El reconocimiento de éste, fundamenta el desarrollo
de terapias efectivas para su mejor funcionamiento en las enfermedades
del intestino.
El campo de los neurogastroenterólogos se inicia
a partir del siglo XIX con los trabajos pioneros de los investigadores
ingleses William
M. Baylis y Ernest H. Starling quienes demostraron que la aplicación
de presiones en el lúmen intestinal en perros anestesiados resultaban
en una contracción oral y en relajación anal, definiendo
a éstas como ondas propulsivas (la cual la refieren como la ley
del intestino) y denominadas actualmente como ondas peristálticas.
Así concluyen estos dos investigadores que el sistema nervioso
entérico posee una actividad neuronal independiente del sistema
nervioso central (6).
Hasta 1967 se identificaba a la epinefrina y a la
acetilcolina como los únicos neurotransmisores que actuaban a
través del
sistema simpático y parasimpático respectivamente, apareciendo
entonces un tercer neurotransmisor denominado serotonina y agregándose
en la actualidad neurotransmisores como el óxido nítrico,
el péptido vasoactivo intestinal, colecistoquinina, sustancia
P, opiodes, péptido relacionado al gen de la calcitonina, etc.
Pero,
que es la serotonina?. Es la 5-hidroxitriptamina (5-HT), similar a la
histamina y está ampliamente distribuida en el reino animal
y vegetal. Se le encuentra en vertebrados, moluscos, artrópodos,
etc. y en algunas frutas comestibles, nueces, etc. También está presente
en numerosos venenos incluyendo aquellos tan comunes como el de la picadura
producida por ortiga, avispas y escorpiones (7). En el ser humano, la
serotonina es un importante neurotransmisor del cerebro y ha sido relevante
en el conocimiento de la depresión, migraña y otras alteraciones
neurosiquiátricas. Se estima que el 95% de la serotonina corporal
se encuentra en el tracto gastrointestinal en las células enterocromafines
(90%) y en las neuronas entéricas (10%); el 5% restante es encontrado
en el cerebro. Se estima que el total de serotonina corporal es de cerca
de 10 mgrs. (8, 9).
En la década pasada, los antagonistas de la serotonina han sido
usados en el tratamiento de los vómitos inducidos por la quimioterapia,
y algunos agonistas como drogas procinéticas.
En el intestino,
cuando la serotonina es liberada por las células
enterocromafines se da origen a una diversidad de funciones motoras y
sensoriales en el tracto gastrointestinal a través de neuronas
del plexo submucoso y mientérico, los que responden a la 5-HT
a través de una variedad de receptores serotoninérgicos
(Fig.1). La 5-HT inicia respuestas tan diversas como naúseas,
vómitos, secreción intestinal y peristalsis, por tanto
su rol en la fisiología intestinal es la de un neurotransmisor
(10, 11).
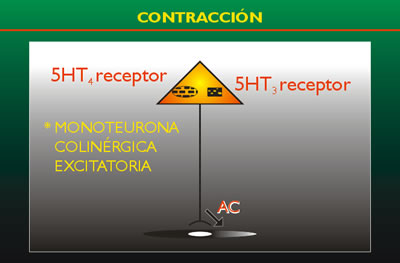
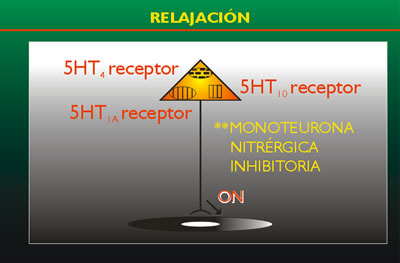
FIGURA
1
|
 |
 |
*
Neurona motora colinérgica excitatoria
** Neurona motora nitrérgica inhibitoria
El
esquema muestra los principales roles de los receptores
de serotonina en el tracto E.1. la 5-HT estimula
a los receptores 5-HT3 ó 5-HT4d de las neuronas
colinérgicos entéricas para liberar
acetil-colina (AC) resultando en contracción
del músculo liso. La 5-HT4, 5-HT1a ó 5-HT1d
de las neuronas inhibitorias entéricas o nitrérgicas
para liberar óxido nítrico (ON) y resultar
en relajación del músculo liso.
|
|
Gershon (11) fue el primero en sugerir que
la serotonina podría
ser un transmisor en el intestino y que la 5-HT es la responsable en
la inducción de potenciales postsinápticos excitatorios
lentos registrados en las neuronas entéricas, así como
también juegan un rol menor como transmisor de potenciales postsinápticos
excitatorios rápidos. En estudios fisiológicos del músculo
liso intestinal, la 5-HT puede hacer contraer o relajar el intestino
dependiendo de las condiciones experimentales.
La 5-HT activa tanto
la neurona motora intrínseca excitatoria
e inhibitoria. Así, puede estimular neuronas colinérgicas
para liberar acetil colina resultando en una contracción del músculo
liso o por el contrario, estimular neuronas nitrérgicas inhibitorias
para liberar óxido nítricolo cual resultará en la
relajación de la musculatura lisa.
La 5-HT ha demostrado participar
en la transducción sensorial
desde la mucosa (Fig. 2). Cuando hay un incremento de la presión
intraluminal, el SNE "detecta" se produce un mecanismo transepitelial
por el cual las células enterocromafines liberan 5-HT y éste
se comporta como una molécula o señal química con
el objetivo de estimular terminaciones nerviosas de la pared intestinal
(fibras nerviosas aferentes vagales e intrínsecas). Estas últimas
inician el reflejo peristáltico (Fig. 2) (12).
Una estimulación
de la mucosa, tal como un golpe o presión,
activa la 5-HT de las neuronas aferentes intrínsecas en el plexo
submucoso; este efecto está incrementado por los inhibidores de
la recaptación selectiva de la serotonina, como la fluoxetina,
la cual inhibe la captación mucosa de 5-HT (13).
Las
funciones de las células enterocromafines todavía
no han sido definitivamente establecidas. Una hipótesis es que
juegan un rol paracrino, regulando la tasa de proliferación de
los enterocitos vecinos por secreción de 5-HT. Una segunda hipótesis
postula una función de tipo neurocrina, por la cual, estas células
son transductoras sensoriales que responden al incremento de la presión
(o distorsión del vello), por secreción de 5-HT, la cual
activaría a las neurona serotoninérgicas de la submucosa
(Fig. 2). La 5-HT provoca contracciones de las células musculares
lisas del intestino ya sea por estimulación de los receptores
5-HT3 de las células nerviosas o de los receptores 5-HT2 del músculo
(13).
FIGURA
2
|
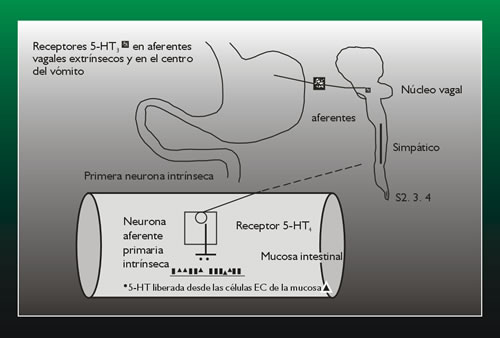 |
El esquema muestra los principales roles de los receptores
de serotonina en el
tracto gastrointestinal. Cuando el intestino es estimulado,
por ejemplo: merementando la presión intraluminal
la 5-HT es liberada para cumplir con su función
sensorial desde las células enterocromatines
de la mucosa y así estimula a las
neuronas aferentes primarias intrínsecas vía
los receptores 5-HT4 juegan así el
rol de un marcador molecular, finalmente son estimulados
los aferentes intrínsecos. Los receptores 5-HT3
viscerales (vagal) están también presentes
en
los aferentes viscerales (vagal) y en los núcleos
del tallo cerebral. Estos aferentes están comprometidos
en los vómitos inducidos
por la quimioterapia. |
|
La serotonina es también un potente secretagogo intestinal.
No están aclarados los mecanismos por los cuales la serotonina
induce la secreción intestinal. Un receptor 5-HT2 localizado
en la mucosa está comprometido en el transporte electrolítico
intestinal estimulado por la serotonina (Fig. 3). Se ha demostrado
su compromiso en la secreción de electrolitos y fluidos en la
diarrea producida por la toxina del cólera (14) y en fisiopatología
de la diarrea por carcinoide (15).
FIGURA
3
|
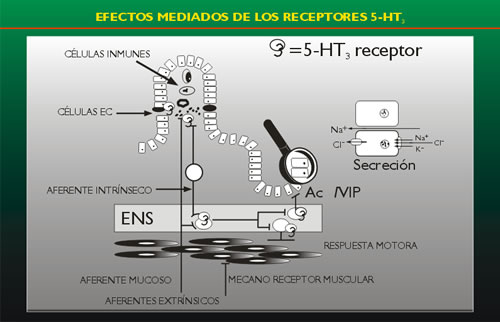 |
Tipos y subtipos de receptores de la
serotonina
Hay varios subtipos de receptores de la 5-HT y se
encuentran en las neuronas entéricas, en las células
enterocromafines, en el músculo liso gastrointestinal y probablemente
en los enterocitos y en el tejido inmune (16).
A través de técnicas
combinadas farmacológicas
y de clonación molecular hasta ahora se han identificado siete
tipos de familias y múltiples subtipos de receptores de 5-HT
(17).
En el tracto gastrointestinal, los subtipos 5-HT 3
y 5-HT4 parecen ser los más importantes, pues están relacionados
con los efectos que la 5-HT ejerce sobre la motilidad y la sensibilidad
visceral.
Los receptores de 5-HT3 activados van a ejercer un
efecto modulador sobre la sensibilidad dolorosa visceral y la motilidad.
Por esta razón,
los antagonistas de estos receptores disminuyen la reactividad sensorial
entérica y consecuentemente reducen el dolor en el SII (17).
Por
otro lado, la activación de los receptores 5-HT4 incrementa
el tono muscular liso, la secreción de electrolitos y el reflejo
peristáltico, con lo cual influyen en un aumento del volumen
y frecuencia defecatoria, así como la urgencia para defecar
de los pacientes con SII.
Hipersensibilidad visceral
Como ya se dijo anteriormente, el SII está asociado
en algunos pacientes con tránsito gastrointestinal alterado,
con una variedad de anormalidades manométricas del intestino
delgado y grueso, sensibilidad visceral aumentada y aspectos psicológicos
que incluyen ansiedad y depresión. El rol de la hipersensibilidad
visceral en el SII ha merecido mucha atención últimamente
(18-20).
Existen otros síndromes funcionales digestivos
relacionados con hipersensibilidad visceral como el dolor toráxico
no cardiaco, la dispepsia no ulcerosa, la proctalgia fugaz, la coxigodinia,
etc.
y otros no digestivos como la fibromialgia, síndrome migrañoso,
dolor ginecológico, dispareumia, dismenorrea, cistitis intersticial,
etc; por el cual, muchos pacientes, en especial de sexo femenino asocian
o alternan estas entidades al SII (21).
Los centros del sistema nervioso
central modulan periféricamente
la actividad motora y sensorial del intestino (y viceversa) a través
de los neurotransmisores. Por tanto los síntomas gastrointestinales
pueden ser el resultado de la desregulación de la mediación
del eje cerebro-intestino (22).
Las encefalinas, la sustancia P, el
péptido
relacionado al gen de la calcitonina, el óxido nítrico,
la 5-HT, la colecistoquinina y otras sustancias influyen en la sensibilidad
dolorosa,
la motilidad gastrointestinal, el comportamiento emocional y la inmunidad
(20).
Para comprobar la hipótesis de que la 5-HT
está comprometida
en la etiología del SII , Bearcroft y cols. (23) midieron los
niveles plasmáticos de 5-HT en pacientes con SII con predominancia
de diarrea, encontrando altos niveles de liberación post-prandial
de 5-HT en el plasma de estos pacientes en comparación con los
controles sanos, sugiriendo un posible rol de la 5-HT en los síntomas
post-prandiales.
En este sentido es bueno tocar el rol atribuible hoy
a una gastroenteritis infecciosa previa que parece ser un factor precipitante
en alrededor
de un tercio de los pacientes con SII (24, 25).
Ante la inflamación,
se generan una serie de sustancias químicas
que van a tener diferentes efectos ante las neuronas sensoriales ya
sea activándolas, sensibilizándolas, esto es, incrementando
su respuesta a la estimulación y, alterándolas en su
estructura. Este fenómeno es denominado neuroplasticidad y se
produce cuando un estímulo repetido incrementa la respuesta
de la neurona de segundo orden de manera prolongada produciéndose
cambios que pueden hacerse casi permanentes en la fisiología
de la médula espinal. Este fenómeno tiene una serie de
consecuencias:
- Permiten su estimulación por estímulos
que normalmente no son dolorosos: Alodinia.
·
Incremento de la respuesta a un estímulo nóxico : hiperalgesia.
(20).
Los estudios efectuados en animales sustentan la hipótesis
de que la inflamación previa podría producir una disfunción
neuromuscular continua en el intestino. En consecuencia, una inflamación
leve en la mucosa podría perturbar el funcionamiento neuromuscular
localmente y en lugares remotos sin inflamación. La disfunción
podría persistir después de la reducción de la
inflamación en la mucosa. Los estudios clínicos efectuados
en brotes de intoxicación alimentaria indican que la prevalencia
de dicha condición en la población es 15% (26,-28).
Sin
embargo, no hay lesiones identificables de inflamación
en las biopsias colónicas o rectales de rutina en pacientes
con SII. Los experimentos muestran una mayor expresión de "marcadores
inflamatorios" y son considerados mediadores putativos de la disfunción
neuromuscular entérica en la inflamación: citoquinas
(IL-1, IL-6, TNF- alfa, LIF), mediadores lipídicos (PG-E2, leucotrieno-D4,
PAF), factores de crecimiento (factor de crecimiento neural), otros
como el óxido nítrico (29).
En resumen, el inicio del
SII en algunos pacientes es agudo. Estos hallazgos favorecerían
el uso de nuevos enfoques terapéuticos
.
Rol de la hipersensibilidad intestinal
La hipótesis de que la molestia "funcional" debe
originarse desde un bajo umbral sensorial fue planteada hace más
o menos 20 años. Desde entonces existe un gran número
de estudios que han confirmado que la distensión rectal crea
una sensación de dolor en pacientes con SII con volúmenes
menores que en controles sanos (21).
Es interesante observar que esta
hipersensibilidad puede también
comprometer al esófago y por lo tanto quizá represente
un desorden generalizado del tracto gastrointestinal o de la inervación.
La hiperalgesia no se extiende a la percepción somática
dolorosa.
Las mediciones no sólo están influidas
por la calidad del material del balón distendible sino también
y de modo más importante, por la forma como se incrementa el
volumen. Un incremento continuo del volumen podría inducir a
la acomodación del recto, en cambio, una distensión
intermitente no.
A los pacientes con SII que se quejaron de diarrea
se les encontró ser
más sensibles a la distensión rectal, mientras que aquellos
que se quejaban de constipación tendieron a ser menos sensibles.
Sin embargo, esta distinción no es infalible y no debe permitir
una diferenciación entre pacientes con SII y normales, o entre
pacientes con predominancia de diarrea y constipación (30-32).
La
hipersensibilidad del intestino puede nacer de diferentes estructuras
nerviosas asociadas con la experiencia consciente del estímulo,
tales como:
- Receptores de la mucosa
- Receptores de la pared intestinal
- Aferentes intestinales
- Mecanismos centrales
- Cambios del humor
Existen estímulos químicos locales que
pueden provocar incremento de la motilidad en los pacientes con SII: ácidos
grasos de cadena corta, productos finales de la degradación
de la fibra dietaria en el colon, ácidos biliares, etc. (33).
Rol de la hipersensibilidad del sistema nervioso central
La hipersensibilidad puede ocurrir tanto en el sistema
nervioso central y periférico. Aquí las alteraciones
de la médula
espinal y del cerebro pueden ser distinguidos.
La evidencia para demostrar
la hipersensibilidad de los aferentes esplácnicos lumbares en
pacientes con SII se logra por la incapacidad del recto (aplicado con
lidocaína) para la percepción
de la humedad rectal en respuesta a la distensión con vaciamiento
lento.
A nivel cerebral, puede demostrarse usando la tomografía
por emisión de positrones, en donde se aprecia cambios de tipo
diferente actividad cerebral regional entre pacientes con SII y controles
(34).
Rasgos psiquiátricos y psicológicos
Los factores psicológicos parecen ejercer una
fuerte influencia en algunos pacientes con SII. La tensión y
las emociones alteran la motilidad del intestino delgado y del colon
y no menos del 50% reportan
un episodio agudo de estrés precediendo al inicio de la condición
o muchos pacientes reportan que el estrés empeora sus síntomas,
y los pacientes con SII experimentan más eventos de estrés
en su vida respecto a otros (35, 36).
El psiquismo y la función
gastrointestinal pueden actuar en más de un nivel. La intensidad
de un estímulo puede ser
incrementada o disminuida en el nivel espinal por vía descendente
o por inhibición desde el cerebro y tal incremento puede ocurrir
en algún porcentaje de pacientes con SII (37). Es razonable
que los aferentes puedan favorecer de este modo sensitivo, que estímulos
fisiológicos sean experimentados como dolor (alodinia). Un ejemplo
fácil de referir como problema de tipo central puede ser una
persona ansiosa con temor a tener una seria enfermedad, por ejemplo
el cáncer.
Muchos autores han encontrado diferencias entre los
pacientes con SII y controles, por diferentes rasgos psicológicos,
tales como distress somático, ansiedad, depresión, dificultades
del sueño, propensión a la fatiga, sentimientos hostiles
y tristeza.
Por último, los individuos que reportan abuso físico
o sexual tienen mayor probabilidad con respecto a otros de tener síntomas
de intestino irritable (38); sin embargo, su rol en el desarrollo de
los desórdenes gastrointestinales funcionales es controversial.
Conclusiones
Al momento actual y a la luz de lo descrito anteriormente
podemos concluir que los mecanismos fisiopatológicos mejor reconocidos
en el SII, son:
-Motilidad anormal: hiperreactividad del músculo liso, caracterizada
por una exagerada respuesta motora por una variedad de eventos provocativos.
-Hipersensibilidad visceral
-Desregulación del sistema nervioso autonómico.
-Anormalidades en los niveles de los neurotransmisores tales como
la serotonina (5-HT) o de los receptores para estos neurotransmisores.
-Sostenida activación del sistema inmune después de infección,
estrés u otros factores sicológicos.
Estos mecanismos pueden ocurrir interactuando entre ellos y no son
excluyentes entre si.
Bibliografía
1. Knowles, JB; Drossman DA. Evidence Based Gastroenterology
and Hepatology. Irritable Bowel Syndrome: Diagnosis and Treatment.
B.M.J. Books. London,
1999;105:241-59.
2. Doe Young Kin, MD; Michel Camilleni, MD. Serotonin: A mediator of
the Brain-Gut connection. Am J. Gastroenterol 2000; 95:2698-09.
3. Gwee, KA; Leong, YL; Graham, C. et al. The role of psychological
and biological factors in postinfective gut dysfuntion. GUT 1999;44:400-6
4. Furness, JB; Costa, M. The enteric nervous system. Edimburgh: Churchill
Livingstone, 1987.
5. Gershon, MD; Tanvir, H. Release of endogenous 5- Hydroxy- Tripptamina
from rsting and stimulated enteric neurons. Neuroscience 1981;6:2277-86.
6. Soriano, AC. Síndrome de Intestino Irritable-Fisiopatología.
S.G. del Perú Tópicos selectos en GE III 2002:140-44.
7. Tyce, GM. Biochesmistry of serotonina- In: Vanhoutte PM, ed. Serotonina
and the cardiovascular system. New York: Raven Press, 1985:1-13.
8. Bertaccini, G. Tissue 5 hydroxytryptamine and urinary 5- hydroxy
indoleacetia and after pontial or total removae of the gastrointestinal
tract in
the rat. J. Physio (Lond) 1960;153:239-49.
9. Espramer, V; Testini, A. Observations on the release and turnover
rate of 5 - hydroxytryptamine in the gastrointestinal tract. J. Pharm
Pharmacol
1959;11:618-23.
10. Verbeuren, TJ. Interatction of 5 - hydroxytryptamine with autonomic
and sensory neurons. In: Forzard JR, ed. The pevipheral actions of
5 - Hydroxytryptamine inperipheral tissue. Oxford University Press,
1989;1-25.
11. Gershon, MD. Review article: Roles played by 5 hydroxytyptamine
in the physiology of the bowel. Aliment Pharmacol Ter 1999;13:15-30.
12. Bulbring, E; Crema, A. Observations concerning the action of 5
Hydroxytryptamine on the peristaltic reflex. Br. J. Pharmacol 1958;13:44-57.
13. Chen, JX; Pan, H; Rothman, TP. et al. Guinea pig 5 - Ht transporter:
cloning, expression, distribution, and function in intestinal sensory
reception. Am. J Physiol 1998;275:G433-48.
14. Lundgien, 0.5: Hydroxytryptamine, enterotoxinas, and intestinal
fluido secretion. Gastroenterology 1998;1009-12.
15. Peart, WS; Robertson, JIS. The effect of a secretonin autogonist
(UML 491) in carcinoide disease lancet 1961;ii:1172-4.
16. Gelsamer, A; Merger, M; Kilburger, H. Modulation by 5- HT3 and
5 HT4 receptors of the release of 5 - Hydroxytriyptamine from the guinea
pig small intestine. Nauryn Schmiadebergs Arch Pharmacol 1993;377:137-40.
17. Barner, NM; Sharpt, T. A review of central 5 HT receptors and their
funtion. Neuropharmacology 1990;38:1083-152.
18. Cervero, F; Janig, W. Visceral noniceptors: A new world order?
Trends Neurosci 1992;107:271-93.
19. Willis, WDJ. Mechaincal Allodynia: A role for sensitised noniceptive
tract cells with convergent imput from mechano - receptors and nomiceptors?
Am Pain Soc J 1993:2: 23-33.
20. Mantilla, L. Hipersensibilidad visceral. Enf del Ap. Digestivo(6);1:18-24.
21. Rao, SSC. Clinical evaluation of visceral pain. Gastrointestinal
motility. Klower Academic/Plenum Publishers New York 1999; 265-76.
22. Camilleri, M; Ford, MJ. Functional Gastrointestinal disease and
the autonomic nervous system. A way a head? Gastroenteorlogy 1994;106:1114-8.
23. Bearcrof, T. CP; Penett, D. Flarthing MJG - Portprandial pharma
5 - Hydroxytryptamina in diarrhea predominant irritable bowel syndrome:
A pilot stydy. GUT 1998:42-6.
24. Gwee, KA; Leong, YL; Graham, C. et al. The role of psychological
and biological factores in postinfective gut dysfuntion. GUT 1999;44:400-6.
25. Choi, M-G; Camilleri, M; O Brien, MD. et al. A pilot
stydy of motility and tone of the left colon in diarrhea due to functional
disorders
and dysantonomia. Am J. Gastroenterol. 1997;92:297-302.
26. Mc. Klendrick, MW; Real, NW. Irritable bowel
syndrome post salmonella infection. J. Infect 1994;29:1-3.
27. Gwee, KA; Graham, JC; Mckandrick, MW. et al. Psychological score
and persistence of irritable bowel after infections diarrhea. Lancet
1996:347:150-3.
28. Neal, KR; Hebden, J; Spiller, R. Prevalence of Gastrointestinal
syntoms six months after bacterial gstroenteritis and risk factors
for development
of the irritable bowel syndrome: postal 5 urvey of patients. Br.
Med J 1997;314:779-82.
29. Pecters, TL; Van Assche, G. et al. Neuropeptide
mediated regulation of Gastrointestinal motility in the inflamed
gut. Neurogastroenterologia
1997(2):54-6.
30. Ritchie, J. Pain from distension of the pelvic colon by inflamating
a balloon in the irritable bowel syndrome: GUT 1973; 14:125-32.
31. Prior, A; Maxton, DG; Whorwell, PJ. Anorectal manometry in irritable
bowel syndrome: differences between diarrhea and constipation predominant
subjects. GUT 1990;31:458-62.
32. Mertz, H; Maliboff, B; Munakata, J. et al. Altered rectal perception
is a biological marker of patients with irritable bowel syndrome.
Gastroenterology 1995;109:40-52.
33. Tafur, I; Basu, P; Hammond, P. et al. Effect of bile acid phfusion
on colonic motor function in patients with the irritable colon syndrome.
GUT 1980;21:843-7.
34. Silverman, DHS; Manakata, JA; Ennes, H. et al. Regional cerebral
activity in normal and pathological perception of viceral pain. Gastroenterology
1997;112:64-72.
35. Hislop, IG. Psycological significance of the irritable colon syndrome.
GUT 1971;12:452-7.
36. Whitehead, WE; Crowell, MD; Robinson, JC. et al. Effects
of stress full life events on bowel symptoms: subjects with irritable
bowel
syndrome compared with subjects without bowel dysfunction GUT 1992:33:825-30.
37. Lembo, T; Munakate, J; Mertz, H. et al. Evidence
for the hippersentivity of lumber splanchnic afferents in irritable
bowel syndrome. Gastroenterology
1994;107:1686-96.
38. Talley, NJ; Fett, SL; Zinsmeister, AR; Melton, LJ. Gastrointestinal
tract syntoms and self-reported abuse: a population. Based study.
Gastroenterology 1994;107:1040-9
(*) Jefe de Servicio de Gastroenterología,
Hospital Nacional Edgardo Rebagliati Martins - EsSalud.
Profesor Asociado de la Facultad de Medicina de la Universidad Nacional
Mayor de San Marcos.
|