Características clínicas de la Esclerosis Lateral Amiotrófica en el Instituto Nacional de Ciencias Neurológicas
Luis Torres Ramírez (1), Erik Alberto Guevara Silva (2), Gladys Mendoza Suárez (2), Carlos Cosentino Esquerre (3)
Resumen
Antecedentes: La Esclerosis Lateral Amiotrófica (ELA) es una enfermedad neurodegenerativa progresiva generalmente idiopática de curso fatal, afecta a las motoneuronas superiores e inferiores. Objetivos: Describir las características clínicas y demográficas de pacientes con ELA hospitalizados en un período de 22 años, desde enero de 1985 a agosto del 2007 en el Departamento de Enfermedades Neurodegenerativas del Instituto Nacional de Ciencias Neurológicas. Población y métodos: Estudio retrospectivo y descriptivo que incluyó a todos los pacientes con el diagnóstico de ELA de acuerdo a los criterios de El Escorial, hospitalizados en los últimos 22 años. Las historias clínicas de estos pacientes fueron analizadas para obtener los datos clínicos y demográficos en base a una ficha estructurada. Los datos fueron procesados por el programa SPSS versión 13. Resultados: De un total de 109 historias clínicas fueron seleccionadas 85 por cumplir los criterios de inclusión, de las cuales 57 (67.1%) correspondieron a mujeres y 28 (32.9%) a varones. La edad promedio de inicio de los síntomas fue de 51.04 años. El intervalo promedio entre el inicio de los síntomas y la fecha de diagnóstico fue de 20 meses. Las manifestaciones iniciales comprometieron a miembros inferiores en 26 (30.6%) casos, miembros superiores en 19 (22.4%) casos, región bulbar en 32 (37.6%) casos y la forma generalizada desde el inicio se presentó en 8 (9.4%) casos. Conclusiones: Nuestros hallazgos concuerdan con otros trabajos similares; sin embargo, encontramos un predominio del sexo femenino en todos los grupos etáreos. La elevada frecuencia de ELA bulbar se explicaría por incluirse solo pacientes hospitalizados. Se hace necesario más estudios para determinar la verdadera incidencia y prevalencia de esta enfermedad en nuestro medio.
Palabras clave: ELA, enfermedad de Charcot, enfermedad de motoneurona, Esclerosis Lateral Amiotrófica, Perú.
Abstract
Background: Amyotrophic Lateral Sclerosis (ALS) is a progressive, fatal, neurodegenerative disease, mostly idiopatic, that destroys upper y lower motor neurons. This illness most commonly strikes adult people. Objectives: To describe demographic and clinic characteristics in patients with ALS hospitalized over the ten year period from 1st january 1985 to 31st august 2007 in the department of Neurodegeneratives Diseases at Instituto Nacional de Ciencias Neurológicas. Population and methods: It was a retrospective descriptive study, which included patients with ALS according to the criteria of El Escorial, hospitalized during the last 22 years. The medical records of these patients were reviewed to obtain demographic and clinical data of each patient using a standardized data collection form. All the information was analyzed with SPSS program. Results: From a total of 109 clinical records, 85 met the inclusion criteria. Of these 57 (67.1%) and 28 (32.9%) were men. The mean age at onset was 51.04 years. Mean interval between symptom onset and diagnosis was 20 months. The symptoms at onset involved the lower limbs in 26 (30.6%) cases, upper limbs in 19 (22.4%) cases, bulbar region in 32 (37.6%) cases, and the generalized form in 8 (9.4%) cases. Conclusions: Our results agree with that of other similar studies; however, a female predominance was found. A high percentage of bulbar palsy-onset patients could be explained because only inpatients were included. Future studies to determine the true prevalence and incidence in our country are needed.
Key words: ALS, Amyotrophic Lateral Sclerosis,Charcot´s disease,motor neurone disease, Peru.
Introducción
La Esclerosis Lateral Amiotrófica (ELA) es una enfermedad neurodegenerativa clínica y genéticamente heterogénea, de etiología desconocida cuyas primeras descripciones de Charles Bell en 1830 se referían a pacientes con afectación puramente motora con preservación de la sensibilidad y memoria. Posteriormente en 1869, Charcot describió pacientes con pérdida difusa de las neuronas motoras en la médula espinal, refiriéndose a un síndrome de disfunción motora progresiva debido a degeneración celular de las astas anteriores; de esta manera Charcot describió la “Esclerosis Lateral Amiotrófica” razón por la cual también se la conoce como enfermedad de Charcot (1,2). Las patologías de la motoneurona incluyen a la atrofia muscular progresiva, parálisis bulbar progresiva, esclerosis lateral progresiva y la esclerosis lateral amiotrófica familiar (3). La Esclerosis Lateral Amiotrófica es la más común de todas éstas, caracterizada por compromiso de neuronas motoras superiores e inferiores a nivel bulbar y/o espinal (4).
Existen varias hipótesis para explicar la etiopatogenia y fisiopatología. Algunas familias presentan mutaciones en el gen de la superóxido dismutasa del cobre y zinc (5,6), estas formas ocurren entre 5 a 10% de los casos (7,8). También se plantea una alteración de la inmunidad (9), influencia de factores ambientales (10) y determinadas modificaciones en la concentración de minerales en el medio ambiente (11).
El inicio de la enfermedad es generalmente entre los cincuenta y sesenta años, rara vez antes de los 20 años, con predominio del sexo masculino en los casos de inicio juvenil (12).
La frecuencia de ELA según la etnia es un tema controversial, estudios de polimorfismo genético sugieren que el antecedente étnico puede modificar la predisposición a esta enfermedad; una revisión sistemática de 64 publicaciones demuestra una ocurrencia uniforme de ELA en las poblaciones caucásicas de Europa y Norteamérica, por el contrario, los datos epidemiológicos sugieren que la incidencia es más baja en poblaciones africanas, asiáticas e hispanas; es difícil establecer conclusiones definitivas debido a la heterogeneidad metodológica de los estudios en poblaciones no caucásicas (13). Los primeros síntomas son pérdida progresiva de fuerza y masa muscular en extremidades superiores, trastornos de la articulación de la palabra (voz gangosa, dificultad para mover la lengua) por compromiso de los músculos de la laringe y lengua. La debilidad se presenta primero en las extremidades (60 - 85%) o región bulbar (15 - 40%), en las extremidades ocurre en un patrón asimétrico y distal, comúnmente como una mano en garra o un pie caído (14, 15-27).
El diagnóstico de ELA es probablemente correcto en el 95% de los casos. Sin embargo, debido a que no existe una prueba diagnóstica específica, algunas veces es difícil diferenciarla de otras alteraciones de la motoneurona. Los criterios formales son utilizados para los ensayos clínicos pero pueden ser muy restringidos, algunos pacientes fallecen por ELA sin ser candidatos para algún ensayo terapéutico (18).
En 1990, el subcomité de ELA de la Federación Mundial de Neurología se reunió en el monasterio de El Escorial para establecer los criterios diagnósticos, éstos fueron publicados en 1994, revisados en 1998 y publicados nuevamente el año 2000 (Tabla 1) constituyéndose en criterios estandarizados para estudios de investigación (19).
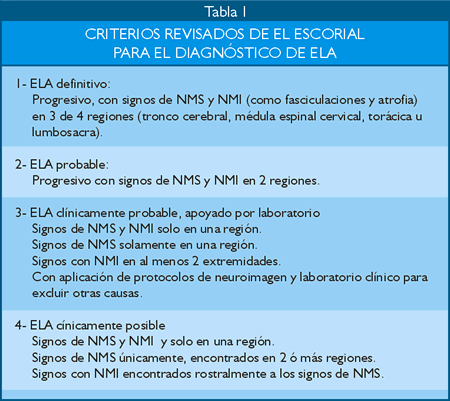 |
NMS:Neurona motora superior
NMS:Neurona superior inferior
Traducido de El Escorial revisted: Revised ctiteria for the diagnosis of A (19). |
El diagnóstico es clínico, entre los exámenes auxiliares, la electromiografía (EMG) es una herramienta importante para el diagnóstico de ELA, permite medir la conducción nerviosa y ofrece unos hallazgos distintos de cualquier otra enfermedad neuromuscular. Es frecuente que encontremos lesiones en nervios aparentemente sanos, correspondientes a músculos que parecen normales pero que, en realidad, están afectados. El uso de la EMG cuenta el número de supervivencia de motoneuronas pudiendo volverse en objetivo de la eficacia de la terapia médica (20).
El tratamiento está dirigido a aliviar los síntomas, como calambres, espasticidad, alteraciones del sueño, problemas de salivación y dificultad respiratoria. Por ahora no existe ningún tratamiento efectivo contra la ELA, sin embargo los descubrimientos de determinados factores de crecimiento neuronal y de agentes bloqueadores del glutamato, se muestran prometedores para detener la progresión de la enfermedad (21).
En nuestro país solo existe un estudio similar sobre variantes clínico electromiográficos y ninguno que establezca la verdadera prevalencia e incidencia de esta patología en nuestro medio. Este trabajo tiene por objetivo describir las características clínicas y demográficas de pacientes con diagnóstico de ELA hospitalizados desde enero de 1985 a agosto del 2007 en el Departamento de Enfermedades Neurodegenerativas del Instituto Nacional de Ciencias Neurológicas.
Material y métodos
El estudio es de corte longitudinal retrospectivo y de carácter descriptivo. Se revisaron las historias clínicas de todos los pacientes con el diagnóstico de ELA hospitalizados en los últimos 23 años (desde enero de 1985 hasta agosto del 2007) en el Departamento de Enfermedades Neurodegenerativas del Instituto Nacional de Ciencias Neurológicas, y que fueron evaluados por uno de los investigadores (LTR).
Las historias clínicas fueron revisadas para obtener los datos clínicos y demográficos, para ello se utilizó una ficha estructurada y precodificada donde se incluyeron datos generales de los pacientes, factores de riesgo, diagnóstico clínico, neurofisiológico y resultados de laboratorio. La categoría diagnóstica se determinó de acuerdo a los criterios de El Escorial.
Criterios de inclusión
El estudio incluyó a todo paciente con diagnóstico de ELA de acuerdo a los criterios de El Escorial, con hallazgos electromiográficos compatibles (fibrilaciones, ondas positivas, fasciculaciones, patrón de interferencia incompleto).
Criterios de exclusión
Pacientes que se internaron con presunción diagnóstica de ELA pero que posteriormente se demostró que se trataba de otra enfermedad de motoneurona. No se incluyeron aquellas historias clínicas con datos incompletos.
Análisis estadístico
Se utilizó el programa estadístico SPSS 13. Los resultados se expresaron mediante pruebas estadísticas descriptivas, gráficos, cuadros de distribución de frecuencias y porcentajes para la determinación de la magnitud y características de la problemática en estudio.
La información recogida se consideró confidencial y de manejo exclusivo por parte del grupo investigador. Los resultados son expresados de manera estratificada o global sin identificación de personas.
Resultados
De un total de 109 historia clínicas fueron seleccionadas 85 por cumplir los criterios de inclusión. Encontramos 57 mujeres (67.1%) y 28 varones (32.9%). Todos los pacientes que ingresaron al estudio cumplieron con los criterios diagnóstico de El Escorial, 60 pacientes (70.5%) pertenecieron a la categoría diagnóstica de ELA probable (Gráfico 1).
El promedio de la edad de inicio de la enfermedad fue de 51.04 años. El rango de edad de inicio de la enfermedad con mayor número de casos estuvo entre los 41-50 años con 22 casos (25.9%), seguido por el rango de edad de 51- 60 años con 21 casos (24.7%); de tal manera que la mitad de la población (50.1%) se encontraba entre los 41 a 60 años, la edad más precoz de aparición de síntomas fue a los 22 años y la más tardía, a los 82 años de edad; la edad de inicio según sexo también se presenta mayormente en el rango de 41 a 60 años (Tabla 2).
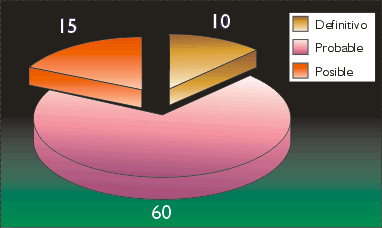 |
| Gráfico 1. Pacientes con ELA según categoría diagnóstica. |
La mayoría de pacientes (53%) mostraron la forma espinal de la enfermedad, es decir con mayor compromiso de extremidades, mientras que la forma bulbar pura se presentó en un 37.6% (Gráfico 2).
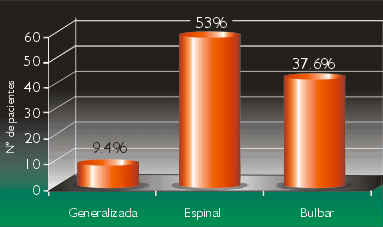 |
| Gráfico 2. Pacientes con ELA según categoría clínica de inicio. |
En 31 casos (39.5%) la enfermedad comenzó con trastornos en el habla (dificultad para articular, disfonía) algunas veces acompañado de síntomas en las extremidades, la debilidad en miembros inferiores (a predominio izquierdo) fue el segundo síntoma más frecuente como debut de la enfermedad (Tabla 3).
En relación al tiempo de enfermedad al momento del diagnóstico, la mayoría de los pacientes se encontraban entre 6 meses a dos años (70.4%), el promedio fue de 20 meses (Tabla 4). No se encontró ningún caso con antecedente familiar.
Discusión
La Esclerosis Lateral Amiotrófica es la más común de un grupo de trastornos en los cuales existe una degeneración progresiva relativamente selectiva del sistema motor, tanto de la neurona periférica (neuronas del asta anterior de la médula, preferente en los engrosamientos cervical, lumbosacro; neuronas motoras del tronco cerebral, especialmente del bulbo) como de la central (esclerosis progresiva del cordón lateral de la médula o haz piramidal cruzado y motoneuronas superiores en la quinta capa de la corteza cerebral).
Estudios epidemiológicos muestran una incidencia relativamente uniforme a nivel mundial, a excepción de algunas regiones endémicas en el oeste del Pacifico, que oscila entre 1.5 - 6/100 000 hab./año, una prevalencia que va de 0.8 (Ciudad de México) a 8.5 por 100 000 personas (Suecia), finalmente, la mortalidad está alrededor de 1.9/100 000/año (22,23). La prevalencia de ELA en la isla de Guam es 50 veces más que en cualquier otro lugar (24).
Esta enfermedad afecta a los varones en una proporción casi el doble en relación a las mujeres, y la mayoría de ellos inician la enfermedad por encima de los 45 años. Sin embargo, nosotros encontramos, en los 85 pacientes descritos, un predominio del sexo femenino (67.1%) en una relación hombres/mujeres de 0.5; similar a lo encontrado por Mandrioli et al; quienes estudiaron a 143 pacientes (67 varones y 76 mujeres), la proporción varones/mujeres fue 0.88, la edad de inicio en promedio fue 63.07 años (rango: 26 a 90 años) (23) y al trabajo realizado por Forbes et al; en 130 pacientes con ELA mayores de 80 años, encontraron que el sexo femenino fue el 67 % (21). En la investigación realizada por Tysnes et al; en 148 pacientes con ELA (93 varones y 55 mujeres), la proporción varones/ mujeres fue 1.69 (25). La edad de inicio de enfermedad en nuestra población estuvo entre 22 y 82 años con una media de 51.04, la mayor cantidad de pacientes se encontraban entre los 41 y 60 años, y cuando se analizó por sexos, se evidenció la misma tendencia; hallazgos similares a los de Shimohata et al; quienes, en un estudio retrospectivo de 280 pacientes japoneses con ELA, encontraron que el promedio de edad al momento del diagnóstico fue de 58.3 +/- 11.3 años (26); mientras que Argyriou et al; mostraron una edad promedio de inicio de 60.3 ± 13.5 años en una descripción de 133 pacientes griegos (27); por su parte Kimura et al; describieron que la edad de inicio en los últimos 20 años se había incrementado, de 59.4 años a 62.5 años, cuando compararon un grupo de 50 pacientes con ELA entre 1980-1990 y otro grupo de 50 pacientes diagnosticados entre 1990 y el 2000 (28). Un estudio prospectivo realizado en Irlanda mostró un promedio de 66 años (29). Sin embargo, en otros trabajos como el de Forbes et al; en un análisis prospectivo poblacional de 1226 pacientes con ELA en Inglaterra, se evidenció que la mayoría de ellos (774 pacientes) se encontraban entre 60 y 79 años de edad al momento del diagnóstico (21); así mismo, López Vega et al; en 1988, encontraron que la mayoría de los pacientes estudiados estaban entre 70 a 79 años (30). Esto nos muestra que la edad de inicio de la enfermedad puede estar influenciada por factores geográficos y étnicos entre otros.
Los criterios diagnósticos para ELA incluyen signos de neurona motora superior e inferior, de inicio insidioso y el curso invariablemente progresivo, con una supervivencia inversamente relacionada a la edad de diagnóstico. La mayoría de pacientes (70.5%) que formaron parte de este estudio pertenecieron a la categoría diagnóstica de ELA probable, todos los pacientes tuvieron una evaluación diagnóstica estricta, que incluyó EMG y cuando fue necesario (ELA probable o posible) se realizaron estudios de liquido cefalorraquídeo (LCR) y neuroimágenes para descartar otras patologías.
Esta enfermedad afecta a las personas de distinta forma, generalmente con pérdida de fuerza de manera progresiva, con torpeza, debilidad y disminución de la masa muscular, de predominio distal al principio en una extremidad y posteriormente el lado contralateral. Otras comienzan con calambres continuos y fasciculaciones que aparecen incluso en los músculos no paréticos. Además, en una proporción variable, los pacientes pueden comenzar con síntomas bulbares (cambios en el habla, dificultad en la deglución y/o dificultad respiratoria) (31). En un estudio postmorten de 19 casos para evaluar la distribución rostralcaudal de la pérdida de la neurona motora inferior en relación al lugar del inicio clínico, Ravits et al; concluyeron que la degeneración de la neurona motora inferior es un proceso focal que avanza contiguamente, se va sumando en el tiempo y crea una pérdida que puede ser graduada (32). Encontramos que el síntoma de inicio más frecuente fue a nivel de las extremidades (45 casos, 53%) con predominio de los miembros inferiores (ligeramente mayor en el miembro inferior izquierdo) (30.6%), seguido del compromiso de miembros superiores (22.4%); los síntomas bulbares se presentaron al inicio en 36 casos, pero solo 32 (37.6%) comenzaron con síntomas bulbares puros; ningún paciente inició con síntomas respiratorios. Estos hallazgos son comparables con los encontrados por O´Toole et al; en una muestra de 465 pacientes irlandeses tanto hospitalizados como ambulatorios, donde la proporción del compromiso en extremidades, solamente, región bulbar y la forma generalizada fue de 268, 164 y 33 casos respectivamente (29). Por su parte, Forbes et al; encontraron que en 1096 pacientes con ELA menores de 80 años el compromiso bulbar de inicio fue 33.3% y en 130 pacientes mayores de 80 años éste fue mayor (50%) (21); igualmente, Shimohata et al; describieron que el compromiso bulbar fue de 62.5% en pacientes mayores de 70 años y 23.3% en menores de 70 años (26). Sin embargo, en un estudio de 80 pacientes diagnosticados de ELA en el Departamento de Neurofisiología del INCN en el período 1993-1998, predominó el compromiso inicial de las extremidades (48% en las superiores sobre 30% en las inferiores) lo que algunas veces llevó a un diagnóstico errado en las evaluaciones iniciales del paciente (33); en otras investigaciones predomina también el compromiso de miembros inferiores y el compromiso bulbar sólo constituyó el 16.5% (29) y 19% (28). En un análisis de 108 pacientes en un servicio de rehabilitación, Ravits et al; encontraron que los síntomas en las extremidades iniciaron en el 58.3% de los casos (34). Las fasciculaciones fueron la forma de inicio de enfermedad solo en dos pacientes pero al momento del diagnóstico todos los pacientes con ELA definitivo y probable presentaban este síntoma. El mayor compromiso bulbar encontrado por nosotros se explica por que solo consideramos pacientes hospitalizados, por ende con una enfermedad más avanzada o con un curso más tórpido como es en el ELA de inicio bulbar, mientras que aquellos con inicio en extremidades son de fácil diagnóstico ambulatoriamente. Sería importante entonces, diseñar un estudio de campo para conocer el comportamiento real de esta enfermedad en nuestro medio.
En relación al tiempo transcurrido entre el inicio de los síntomas y el momento del diagnóstico, los valores oscilaron en la mayoría entre 6 meses a dos años con una media de 20 meses. Otros estudios mostraron que este tiempo fue de 18 meses (27), 14.7 meses (28) ó 13 meses (29), Forbes et al; describen que el tiempo de demora del diagnóstico desde el inicio fue de 9.4 meses en mayores de 80 años y de 10 meses en menores de 80 años (21). Es evidente que en países con mayor tecnología, y cuya población acude más tempranamente al médico ante algún síntoma, el tiempo de demora del diagnóstico es menor, nosotros mostramos que el tiempo transcurrido es mayor que las referencias mencionadas pero sería interesante saber que sucede en otras instituciones como la seguridad social, fuerzas armadas y centros privados; en nuestro país, la accesibilidad geográfica a establecimientos de salud de mayor nivel que cuenten con médicos neurólogos es un factor importante a tomar en cuenta.
El fallecimiento, en sujetos con ELA, se produce fundamentalmente por fracaso de la función respiratoria, incluyendo hipoxia, arritmias cardíacas e infecciones broncopulmonares (31), en nuestro estudio retrospectivo solo pudimos encontrar que tres pacientes fallecieron por dificultad respiratoria pero en ninguno de ellos se realizó necropsia por falta de autorización de la familia, del resto la mayoría no tuvo un seguimiento regular debido a que dejaron de asistir a sus controles. Ninguno de los pacientes recibió Riluzol y la mayoría solo recibió tratamiento sintomático (baclofeno, amitriptilina, gastrocinéticos, complejo B) y no farmacológico (rehabilitación, apoyo psicológico, fisioterapia respiratoria). Actualmente nuestro sistema de salud no cuenta con un sistema de seguimiento y monitoreo de pacientes con enfermedades crónicas, más aún, la idiosincrasia de nuestra población hace que, al saber su diagnóstico y contar con pocas opciones terapéuticas, muchas veces no regresen a su médico y busquen otras alternativas “curativas” en sus pueblos.
Entonces, esta enfermedad es una de las más fatales del sistema nervioso central, con una presentación pleomórfica incluso con manifestaciones inhabituales (no descritas en este estudio) como la demencia, defectos sensitivos y síntomas vegetativos; los cuales, si se presentan como síntomas iniciales, podrían desviar nuestra atención hacia otras patologías. Aparte de las zonas motoras afectadas en el ELA, parece que hay un proceso degenerativo en el lóbulo frontal, por lo que son necesarios estudios longitudinales para detectar trastornos progresivos del lóbulo frontal en estos pacientes. Aún cuando es difícil, desde que los pacientes terminan con serias alteraciones neurológicas las cuales impiden una seria exploración del aspecto cognitivo, y por lo tanto no se puede hacer conclusiones al respecto. Algunos autores refieren alteraciones neuropsicológicas en los pacientes con ELA (16); como lo demuestra Duque et al; quienes, en 14 pacientes con ELA, encontraron trastornos neuropsicológicos sobretodo en las funciones del lóbulo frontal, y en particular en la corteza premotora y dorsolateral; los cuales ya habían sido observados en otras investigaciones, en este estudio no se encontró trastornos amnésicos (15). En los registros clínicos de nuestra población estudiada no se realizaron evaluaciones neuropsicológicas.
Somos conscientes de las limitaciones de este estudio por ser retrospectivo, pero no menos importante lo cual se complementaría con trabajos epidemiológicos prospectivos a nivel nacional para conocer la verdadera incidencia, prevalencia de esta enfermedad; así como el tiempo de vida y contar con una estadística propia para hacer mejores comparaciones con estudios extranjeros.
Bibliografía
- Bonduelle M. Sclérose latérale amyotrophique. Rev Neurol (Paris) 1982;138(12):1027-1039.
- Tyler HR, Shefner J. Amyotrophic lateral sclerosis in Handbook of Clinical Neurology (Vinken P J, Bruyn GW, and Klawans HL eds.), Elsevier Science Publishers B. V., Amsterdam 1991;59:169-215.
- Mayeux R. Epidemiology of neurodegeneration. Annu Rev Neurosci 2003;26:81-104.
- Chiò A, Ciccone G, Calvo A. et al. Validity of hospital morbidity records for amyotrophic lateral sclerosis. A population-based study. J Clin Epidemiol 2002;55(7):723-727.
- Rosen DR, Siddique T, Patterson D. et al. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis. Nature 1993;362(6415):59-62.
- Xu Z. Mechanism and treatment of motoneuron degeneration in ALS: what have SOD1 mutants told us?. Amyotroph Lateral Scler Other Motor Neuron Disord 2000;1(4):225-234.
- Baek WS, Desai NP. ALS: pitfalls in the diagnosis. Pract Neurol : pitfalls in the diagnosis. Pract Neurol2007;7(2):74-81.
- Traynor BJ, Codd MB, Corr B. et al. Clinical features of amyotrophic lateral sclerosis according to the El Escorial and Airlie House diagnostic criteria: a population-based study. Arch Neurol 2000; 57(8):1171-1176.
- Engelhardt JI, Appel SH. IgG reactivity in the spinal cord and motor cortex in amyotrophic lateral sclerosis. Arch Neurol 1990; 47(11):1210-1216.
- Berger MM, Kopp N, Vital C, et al. Detection and cellular localization of enterovirus RNA sequences in spinal cord of patients with ALS. Neurology 2000;54(1):20-25.
- Gajdusek DC, Salazar AM. Amyotrophic lateral sclerosis and parkinsonian syndromes in high incidence among the Auyu and Jakai people of West New Guinea. Neurology 1982; 32(2):107-126.
- Ben Hamida M, Hentati F. Maladie de Charcot et sclérose latérale amyotrophique juvénile. Rev Neurol (Paris) 1984;140(3): 202-206.
- Cronin S, Hardiman O, Traynor BJ. Ethnic variation in the incidence of ALS. A systematic review. Neurology 2007; 68(13):1002-1007.
- Pringle CE, Hudson AJ, Munoz DG, et al. Primary lateral sclerosis. Clinical features, neuropathology and diagnostic criteria. Brain 1992;115(Pt 2):495-520.
- Duque P, Paramo MD, Borges M, et al. Alteraciones neuropsicológicas en la esclerosis lateral amiotrófica. ¿No existen o no se detectan? Rev Neurol 2003;36:3-8.
- Lomen-Hoerth C, Murphy J, Langmore S, et al. Are amyotrophic lateral sclerosis patients cognitively normal? Neurology. 2003;60:1094-1097.
- Tallón-Barranco A, Ayuso-Peralta L, Jiménez-Jiménez FJ, et al. Forma de comienzo respiratorio en la enfermedad de moteneurona. Rev Neurol 2000;30(1):51-53.
- Rowland LP, Shneider NA. Amyotrophic lateral sclerosis. N Engl J Med 2001;344(22):1688-1700.
- Brooks BR, Miller RG, Swash M, et al. El Escorial revisited: revised criteria for the diagnosis of ALS. Amyotroph Lateral Scler Other Motor Neuron Disord 2000;1(5):293-299.
- Olney RK, Yuen EC, Engstrom JW. Statistical motor unit number estimation: reproducibility and sources of error in patients with amyotrophic lateral sclerosis. Muscle Nerve 2000; 23(2):193-197.
- Forbes R, Colville S, Swingler R, et al. The epidemiology of amyotrophic lateral sclerosis (ALS/MND) in people aged 80 or over. Age Ageing 2004;33(2):131-134.
- Piemonte and Valle d'Aosta register for Amyotrophic Lateral Sclerosis (PARALS). Incidence of ALS in Italy: evidence for a uniform frequency in Western countries. Neurology 2001;56:239-244.
- Mandrioli J, Faglioni P, Merelli E, et al. The epidemiology of ALS in Modena, Italy. Neurology 2003;60:683-689.
- Reed DM, Brody JA, Holden EM. Predicting the duration of Guam amyotrophic lateral sclerosis. Neurology 1975;25:277-280.
- Tysnes OB, Vollset SE, Larsen JP, et al. Prognostic factors and survival in amyotrophic lateral sclerosis. Neuroepidemiology 1994;13(5):226-235.
- Shimohata T, Yanagawa K, Tanaka K, et al. Longitudinal analysis of age at onset and initial symptoms in patients with amyotrophic lateral sclerosis. Rinsho Shinkeigaku 2006; 46(6):377-380.
- Argyriou AA, Polychronopoulos P, Papapetropoulos S, et al. Clinical and epidemiological features of motor neuron disease in south-western Greece. Acta Neurol Scand 2005;111(2):108-113.
- Kimura F, Shinoda K, Fujiwara S, et al. The changes of clinical characteristics in 100 Japanese amyotrophic lateral sclerosis patients between 1980 and 2000. Rinsho Shinkeigaku 2003; 43(7):385-391.
- O'Toole O, Traynor BJ, Brennan P, et al. Epidemiology and clinical features of amyotrophic lateral sclerosis in Ireland between 1995 and 2004. J. Neurol Neurosurg Psychiatry 2008; 79(1):30-32.
- López-Vega JM, Calleja J, Combarros O. et al. Motor neuron disease in Cantabria. Acta Neurol Scand 1988;77(1):1-5.
- Caroscio JT, Mulvihill MN, Sterling R, et al. Amyotrophic lateral sclerosis. Its natural history. Neurol Clin 1987;5(1):1-8.
- Ravits J, Laurie P, Fan Y, Moore D. Implications of ALS focaity: rostral-caudal distribution of lower motor neuron loss postmorten. Neurology 2007;68:1576-1582.
- Crovetto L, Sifuentes J. Esclerosis Lateral Amiotrófica: variantes clínico-electromiográficas. Rev Per Neurol 1998;4:5-11.
- Ravits J, Paul P, Jorg C. Focality of upper and lower motor neuron degeneration at the clinical onset of ALS. Neurology 2007; 68:1571-1575.
1 Jefe del Departamento de Enfermedades Neurodegenerativas del Instituto Nacional de Ciencias Neurológicas. Lima, Perú.
2 Médicos residentes del 3er año de neurología de la Universidad Nacional Mayor de San Marcos. Lima, Perú.
3 Jefe de la Unidad de Movimientos Involuntarios del Instituto Nacinal de Ciencias Neurológicas. Lima, Perú. |
