Tuberculosis multidrogoresistente extensamente resistente
Eduardo Ticona Chávez (1)
Introducción
La resistencia antimicrobiana es un fenómeno común a todos microorganismos, formando parte de su respuesta frente a la agresión externa; en este caso, la tuberculosis (TB) resistente es una respuesta defensiva del M. tuberculosis frente a los antimicrobianos.
El tratamiento para el M. tuberculosis requiere de un esquema combinado de tres o cuatro drogas, por lo que la resistencia aislada a una de ellas, no necesariamente va a generar un fracaso terapéutico, sin embargo todos los medicamentos antituberculosos, no son igualmente eficaces, por lo que la resistencia a las drogas más eficaces, debilitan profundamente el esquema y sí llevarían al fracaso del esquema. Así se define Tuberculosis multidrogo resistente (TB MDR) cuando existe resistencia a isoniacida (INH) y rifampicina (RFP), y Tuberculosis extensamente resistente (TB XDR) cuando además de las mencionadas, existe resistencia a una quinolona y a una droga inyectable. En el primer caso se falla al esquema de primera línea, y en el segundo caso se falla al esquema de segunda línea.
Estas formas de resistencia, se encuentran muy extendidas en el mundo, dificultando el control de la TB en los últimos 20 años a nivel mundial. La TB es considerada una enfermedad reemergente y un problema de salud pública mayor. A pesar del esfuerzo de la comunidad internacional en la mayor asignación de fondos, el desarrollo de nuevos métodos diagnósticos, y la investigación en nuevas drogas, el panorama para el control de la TB no se ve claro a mediano plazo.
Aspectos epidemiológicos
El surgimiento y su diseminación
La resistencia a los medicamentos anti-TB es de tipo cromosómica, y fue descubierta tempranamente en los años 50s, siendo observada primariamente frente a la STM (1). Luego se apreció que la combinación de fármacos, hacia posible la eficacia terapéutica de los esquemas de medicamentos (2,3), surgiendo así la 1ra base bacteriológica de la terapéutica en TB "combinación de fármacos", que evitaba la selección de cepas resistentes. Así mismo, se apreció una mayor frecuencia de recaídas ante la descontinuación temprana de los esquemas, por lo que la "extensión de la duración del tratamiento" es considerada la segunda base terapéutica de la TB, la cual podía llegar a extenderse a 12 meses o más (4). La aparición de la RFP, en asociación a los otros fármacos (en especial a la INH) logra un esquema potente, por lo que el esquema se reduce a 6 meses, dando paso al llamado Esquema 1 de la Organización Mundial de la Salud (OMS), sobre el cual descansa la Estrategia DOTS (Directly Observed Treatment Short-course) (5). Es importante recordar que la estrategia DOTS considera para su buena aplicación, un compromiso político de los gobernantes para garantizar la disponibilidad de las pruebas de diagnóstico y medicamentos, así como la aplicación del tratamiento de manera supervisada, todo ello para garantizar un tratamiento eficiente y evitar la resistencia. Por ello se buscó expandir la Estrategia DOTS a nivel mundial (6) . Sin embargo, a pesar de los esfuerzos, la TB MDR surge en todos los continentes y se expande, aun en los lugares donde la estrategia DOTS se aplicaba con eficiencia; por lo que la OMS ve la necesidad de propiciar el tratamiento con drogas de 2da línea para pacientes en esta condición. Así mismo, debido al elevado costo del tratamiento, se generan mecanismos que facilitan el acceso a drogas de segunda línea, bajo supervisión y control el cual está a cargo del Comité de Luz Verde (7), sin embargo este esfuerzo, también tiene sus limitaciones y aparece la TB XDR (8-10). Es por ello, que se considera insuficiente la sola aplicación de la estrategia DOTS para el control de la TB en el Mundo, y se comienzan a adicionar nuevas estrategias (11,12). Sin embargo, la mayor parte de ellas siguen considerando un fuerte enfoque biomédico, que hasta el momento no ha mostrado eficacia en los países pobres del mundo (13).
En el Perú, se desconoce exactamente cuándo fue el 1er caso TB MDR, sin embargo se registran los casos desde 1997, apreciándose un crecimiento sostenido hasta el 2004, momento desde que se mantiene constante la incidencia anual (Figura 1); cifras que nos identifican como el país con mayor número de casos de TB MDR en las Américas (9). Por otro lado, la TB XDR se registra desde 1999, y hasta la fecha son 494 casos reportados (Tabla 1) (14). Las Ciudades de Lima y Callao concentran el 80% de los casos de TB MDR y en 89.4% de TB XDR del país (14).
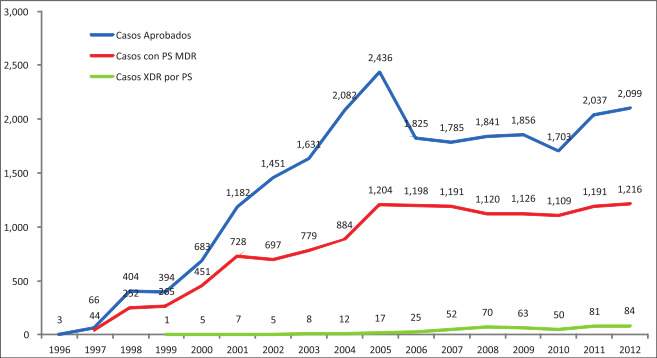 |
| Figura 1. Casos que acceden a drogas de 2o línea por sospecha o confirmación de MDR y Casos XDR confirmados al año 2012. |
El VIH
La aparición de la epidemia del VIH en el mundo, ha limitado significativamente el control de la TB por varios factores, especialmente al incrementar la población susceptible a la enfermedad TB (15,16). Las formas resistentes necesitan muchos años para su evolución y extensión en la comunidad, sin embargo en algunas comunidades de África donde la infección por el VIH es más prevalente, las formas resistentes TB MDR o TB XDR se han hecho muy frecuentes (17,18). Existen reportes que sugieren, que las personas con VIH tienen un mayor tendencia de tener cepas resistentes que los VIH negativos, sin embargo no han mostrado significación estadística (19), siendo probablemente el factor más importante la asociación a brotes en la comunidad o en los servicios de salud donde circulan estas cepas (20-23).
La resistencia un problema complejo
en la prevención y control
Además de las características biológicas del germen y los aspectos epidemiológicos relacionados a su trasmisión, existen factores biológicos en el propio huésped que perturban la eficacia de los antimicrobianos y por lo tanto favorecen la resistencia. Así, Los huéspedes inmunocomprometidos por diferentes condiciones (Infección VIH/SIDA, diabetes, insuficiencia renal crónica, etc), suelen tener una mayor población bacteriana, para lo cual las dosis usuales de los medicamentos pueden ser insuficientes en algunos tejidos. En otras condiciones, la presencia de fibrosis y/o abscesos, impiden la penetración de los agentes antimicrobianos, o se neutralizan por acción del pH, por lo que en tales circunstancias, a pesar de recibirse un tratamiento adecuado, es posible que dichas zonas estén bajo monoterapia, favoreciéndose así la resistencia(24). En este contexto, la resistencia es un fenómeno complejo, donde además de los mencionados, convergen las dificultades operativas en los servicios de salud y los factores sociales relacionados al individuo, siendo estos últimos los menos abordados.
Los grupos de mayor riesgo
de TB MDR
En el Perú se consideran grupos de mayor riesgo de TB MDR, a los siguientes: a) Antecedente de ser contacto de paciente con TB MDR confirmada con Prueba de Sensibilidad (PS) o en tratamiento con drogas de segunda línea,
b) Inmunosupresión asociada a exposición intrahospitalaria: Infección VIH, Diabetes Mellitus, insuficiencia renal crónica, neoplasias, enfermedades terminales, tratamiento crónico con corticoides, otras; c) Recaída en menos de seis meses de egresar como "curado" del Esquema Uno de tratamiento; d) Paciente con tuberculosis multitratada (dos o más tratamientos); e) Personal de salud que incluye estudiantes de ciencias de la salud y promotores de salud que trabajan en TB; f) Residir en los últimos dos años en una zona de elevada prevalencia de TB MDR, g) Población privada de libertad o con antecedentes del mismo; h) Trabajador de establecimientos penitenciarios; i) Usuarios de drogas ilegales; j) Contacto de paciente fallecido por tuberculosis antes tratada; k) Pacientes con antecedente de tratamiento previo particular y/o auto administrado mayor de 30 días; l) Paciente con antecedente de irregularidad al tratamiento; m) Antecedente de hospitalización previa en salas de medicina o emergencia, por más de una semana, por lo menos una vez en los últimos dos años; n)Tratamiento previo con presencia de Reacción Adversa a Fármacos Antituberculosos (RAFA) que obligó a cambiar a dosis sub óptimas y/o suprimir algún medicamento; o) Contacto de paciente que fracasó a tratamiento antiTB (25).
Sin embargo cuando la TB MDR es endémica en una localidad determinada, estos grupos de riesgo se pierden, ya que toda la población de dicha localidad estaría en riesgo. Factor que en la actualidad compromete a todo Lima y Callao.
Características clínicas
Originalmente las características clínicas de un paciente con TB MDR, mostraban a un paciente caquéctico, en mal estado general, con insuficiencia respiratoria crónica, que en algunos casos se asociaban a signos de Cor pulmonale, donde la radiografía de tórax evidenciaba compromiso pulmonar extenso de aspecto fibrocavitario, usualmente bilateral. Este paciente era producto de uno o varios tratamientos generalmente asociado a abandono en varias oportunidades, todo ello facilitando la generación de resistencia de sus cepas (resistencia adquirida).
Sin embargo en la actualidad, existen áreas en el Perú, donde más del 50% de pacientes con TB MDR son casos nuevos de TB (26); es decir, están siendo afectados por una cepa resistente que fue adquirida en la comunidad, como consecuencia de un escenario epidemiológico de circulación de cepas resistentes (TB MDR). En estas condiciones, podemos decir que no hay características clínicas específicas de un paciente con TB MDR en el diagnóstico inicial.
Sin embargo, en el seguimiento de un paciente que inicia tratamiento TB, en quien ignoramos su perfil de sensibilidad, apreciamos algunas características clínicas que nos pudieran sugerir una mala evolución, y por lo tanto la presencia de TB MDR (siempre y cuando el paciente haya sido adherente): no ganancia de peso, persistencia de tos, falta de negativización de la baciloscopía al final del segundo mes de tratamiento, volver a hacerse positiva la baciloscopía, especialmente ante la persistencia de cavidades o lesión pulmonar evolutiva.
Diagnóstico
El diagnóstico de la TB resistente, se realiza única- mente a través del resultado de una prueba de sensibilidad antimicrobiana, que indica resistencia a una o más drogas.
En los países desarrollados, en todos los casos, sea cual fuere la forma clínica de tuberculosis, se le realiza cultivo y prueba de sensibilidad. En los países en desarrollo (debido a los escases de recursos económicos y capacidades de laboratorio), a los casos nuevos se les prescribe un tratamiento estandarizado de primera línea "Esquema 1", sin previo estudio de sensibilidad. Sin embargo, actualmente en el Perú, en escenarios de mayor incidencia de TB MDR, tales como Lima y Callao, se hace imprescindible solicitar el cultivo y la determinación de la sensibilidad, aún siendo caso nuevo de TB.
Sin embargo, la determinación de la sensibilidad antimicrobiana, es compleja, debido a que el M. tuberculosis es un germen de reproducción lenta. Por lo que se requiere de 4 a 6 semanas para su crecimiento en cultivo, y semejante tiempo para la determinación de la sensibilidad por el método convencional "método de proporciones".
Esta difícil situación, motivó el desarrollo de medios líquidos de cultivo, y luego métodos semi-automatizados en un inicio radiométricos y luego no radiométricos (Ej. BACTEC 960), que permiten una mayor rapidez del crecimiento del M. tuberculosis (15 días) (27), pero su elevado costo limita su uso en los países pobres, donde paradójicamente es más necesaria (28). Actualmente esta prueba está disponible en el Instituto Nacional de Salud en el Perú (INS), para casos especiales.
Así, se buscaron pruebas más económicas y fáciles de desarrollar en países en desarrollo, obteniéndose las pruebas rápidas MODS y GRIES, las cuales son pruebas fenotípicas, es decir se observa directamente in vitro el fenómeno de la resistencia de las cepas evaluadas. Estos métodos permiten determinar la sensibilidad (o resistencia) de INH y RFP, es decir nos dicen si la cepa "es o no es TB MDR" en pocas semanas (1 a 4 semanas) (29). Estos métodos, además de su rapidez, son económicos y por lo tanto muy útiles.
Por otro lado, la biología molecular permite identificar genes específicos de resistencia en el M. tuberculosis para algunos medicamentos, lo que trae consigo, la disponibilidad de pruebas genotípicas para la determinación de la resistencia. Así, se encuentra que para la RFP el gen rpo B está asociado a > 95% de las cepas resistentes y para la INH los genes kat G, inh A en el 85% de dichas cepas. Estas determinaciones se pueden hacer en 3-6 horas (GenoType MTBDRPlus®-Hain lifescience, GERMANY) (30), o en 2 horas (Cepheid Xpert MTB/RIF), siendo su mayor inconveniente el costo (31).
Estas pruebas rápidas, tanto fenotípicas, como genotípicas, en el momento actual, solo nos permiten tener información sobre INH o RFP, por lo que en áreas poblacionales donde existen cepas TB XDR o cepas pre-XDR (cepas TB MDR con resistencia adicional a algún inyectable o quinolonas) su ayuda se torna limitada (no nos permite determinar la resistencia a los otros antimicrobianos), teniendo que decidir un tratamiento, que no podremos modificarlo sino hasta 12 semanas después (cuando dispongamos de la pruebas de sensibilidad por el método de proporciones). De cualquier manera, estas pruebas rápidas, cuando expresan sensibilidad a INH y RFP, definen ausencia de TB MDR, y por lo tanto el esquema de primera línea a recibir será seguro.
La prueba de biología molecular disponible en el INS, es GenoType MTBDRPlus®-Hain lifescience, GERMANY (32). El costo de la prueba y las capacidades actuales, aún no permiten su amplio uso a nivel nacional. Actualmente los centros de salud de alta carga en Lima, la solicitan para todos los casos nuevos de TB, restringiéndose para los otros centros en caso exista sospecha de TB MDR. Así mismo, estas pruebas ayudan en pacientes que han iniciado tratamiento sin un cultivo previo, o cuando hay sospecha de fracaso (resistencia) encontrándose bajo tratamiento (que pudiera impedir el aislamiento de la cepa por cultivo) (Figura 2).
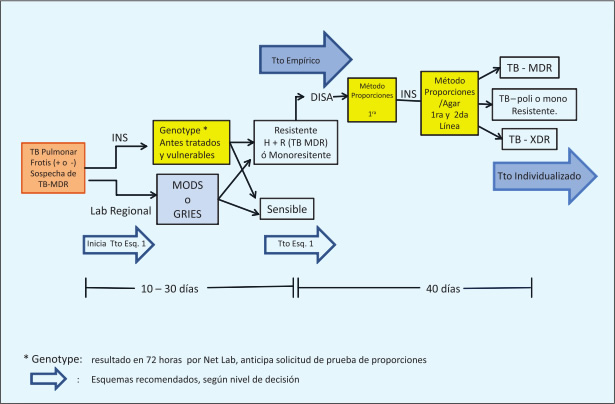 |
| Figura 2. Fluxograma de pruebas diagnósticas en sospecha de TB MDR. Lima y Callao 2012. |
En el país, el fluxograma diagnóstico señala solicitar la prueba MODS (Lima Sur, Callao, Iquitos, Arequipa e Ica) o GRIES (Lima Este, Lima Ciudad, Ucayali, Lambayeque y Junín), donde al determinarse una cepa TB MDR, esta deberá ser enviada al INS para el procesamiento de sensibilidad a todas las drogas de 1ra y 2da línea. En otras regiones, deben de enviar sus muestras para cultivo a los laboratorios regionales correspondientes, las que luego serán enviadas al INS para la determinación de sensibilidad drogas de 1ra o 2da línea según el caso. En la DISA Lima Ciudad se ha incorporado la prueba GenoType, como se mencionó anteriormente (Figura 2).
El diagnóstico de TB en personas con infección VIH/SIDA, resulta algo especial, debido a que el 50% de los casos de TB en personas con infección VIH, tienen baciloscopía negativa. Esto es debido a la falta de respuesta inmunitaria que limita la capacidad en formar cavidades. Por ello, la prueba MODS, resulta más útil en zonas donde existe una mayor proporción de personas con infección VIH, ya que esta, se puede realizar en muestras de esputo, sin necesidad que la baciloscopía sea positiva (a diferencia del método GRIES o GenoType). Es necesario puntualizar, que toda muestra para estudio de TB en paciente con infección VIH, debe ser cultivada además por el método convencional. Esta recomendación es también válida para personal de salud, lo que incluye a los estudiantes de medicina.
Si bien, se está disponiendo cada vez de mejores capacidades para el diagnóstico de la resistencia en TB, se van complejizado cada vez más los procesos en el nivel operativo. Así, en los casos nuevos de TB iniciamos con un esquema 1 y luego con los resultados de las pruebas rápidas que muestran TB MDR (MODS, GRIES o GenoType) lo cambiamos 2 ó 4 semanas después a un esquema estandarizado TB MDR, y es posible que 10 a 16 semanas después debamos de modificar el esquema con el resultado del método de proporciones, que nos precisa claramente el perfil de sensibilidad a drogas de primera y segunda línea. De esta manera, se genera un sistema de envío de muestras a los laboratorios regionales y/o INS, procesamiento de muestras en dichos laboratorios, conocimiento del resultado por el médico tratante, decisión del nuevo esquema, disponibilidad del esquema en el centro de salud correspondiente, y finalmente la toma del tratamiento por el paciente; todos estos procesos con riesgos de retrasos y errores. Además, la decisión del esquema pasa por la evaluación Comité de Evaluación de Retratamiento Intermedio (CERI) y simultáneamente del Comité de Evaluación de Retratamiento Nacional (CERN), que si bien busca una decisión terapéutica adecuada, enlentece el inicio del tratamiento del paciente de manera importante. Actualmente, la nueva gestión en la Estrategia Nacional de Prevención y Control de TB ha buscado disminuir el retraso, facilitando que los CERI decidan las posologías, disponiendo el inmediato envío de las medicinas al centro de salud.
La decisión del esquema de tratamiento para TB resistente, debe de hacerse en todos los casos con una prueba de sensibilidad para drogas de 1ra y segunda línea, las cuales orientan la selección de drogas. En general los medicamentos de segunda línea, son menos potentes, más tóxicos y más caros que las medicaciones para TB sensible; requiriendo un uso prolongado para alcanzar la curación, recomendándose al menos 18 meses de tratamiento (33).
En el Perú, durante la emergencia de TB MDR, no se decidieron los tratamientos de esta manera, debido a falta de capacidades de diagnóstico microbiológico de la resistencia, falta de disponibilidad de drogas, e incluso falta de reconocimiento de este problema de salud pública. Sin embargo, este panorama ha cambiado, debido al adelanto tecnológico, mejores políticas de acceso a medicamentos, mejoras de las condiciones operacionales, mejores capacidades para un tratamiento adecuado. En nuestro país, gracias a los fondos provenientes de la 2da Ronda del Fondo Mundial de Lucha contra el Sida, Tuberculosis y Malaria, se inició el acceso universal a drogas de segunda línea, se fortalecieron las capacidades en el diagnostico de sensibilidad a drogas de 1ra línea en 6 laboratorios regionales y de sensibilidad a drogas de segunda línea en el INS; luego el esfuerzo nacional ha mantenido estas capacidades, incorporado pruebas de biología molecular, pruebas rápidas de diagnostico fenotípico, y un sistema para la decisión de los tratamientos en DISA/DIRESAS y a nivel nacional: CERIs y CERN, que permiten una decisión terapéutica racional.
Sin embargo, la evolución relativamente acelerada de la ampliación de la resistencia desde cepas sensibles a cepas TB XDR en 50 años, nos pone en alarma sobre el futuro próximo. Ya que no se disponen de nuevas drogas, y las correspondientes al grupo 4 ó 5 (Tabla 2) no son tan efectivas como las de los grupos 1 -3. Así, la eficacia del Esquema 1 es del 92%, y luego esta cae para el esquema TB MDR a 85%, y más para un tratamiento TB XDR a 40 a 60%.
Actualmente, la norma nacional peruan a considera varios tipos de esquemas para casos de resistencia (32), llamándose en todos los casos esquemas de "retratamiento", aún tratándose de la 1ra vez que el paciente se encuentre en tratamiento TB:
Retratamiento individualizado para TB MDR
El esquema se basa en los resultados de la prueba de sensibilidad del paciente, para fármacos de primera y segunda línea. En la elaboración de estos esquemas se considera una fluoroquinolona (Moxifloxacino, Levofloxacino) + un Inyectable (Kanamicina, Capreomicina, Amikacina, Estreptomicina) + 1 droga de segunda línea oral (Cicloserina, Etionamida, PAS), + drogas de primera línea: Ethambutol, Pirazinamida. Se puede agregar 2 ó más de las drogas del Grupo 5 (Tabla 2) según el patrón de resistencia si no se logra alcanzar un esquema con por lo menos 3 drogas efectivas (por lo menos dos de ellas bactericidas). La duración del tratamiento es de 18-24 meses, pudiendo aún extenderse por más tiempo.
 |
| WHO Library Cataloguing-in-Publication Data. Treatment of tuberculosis: guidelines - 4th ed. WHO/HTM/TB/2009.420 |
Retratamiento empírico transitorio
para TB MDR
Este esquema se indica sin disponer de los resultados de la PS del paciente, cuando se encuentra en mala condición clínica, y tenga al menos un cultivo positivo o prueba de GenoType. Las indicaciones son en: i) Paciente con TB (nuevo o antes tratado) contacto intradomiciliario de caso índice TB MDR, ii) Paciente con TB en esquema 1, que tiene un resultado de MODS, GRIESS o GenoType que indica resistencia a R y H.
Para la elaboración de dicho esquema se consideran:
a) El antecedente de fármacos previamente recibidos, b) La prueba de sensibilidad del caso índice TB MDR documentado, c) El esquema de retratamiento recibido por el caso índice y su condición de egreso, si lo hubiera, d) El patrón de resistencia local (áreas de alto riesgo) o regional.
El esquema debe ser modificado al recibirse el resultado de la PS del método de proporciones, pasándose así a un esquema individualizado. Si el resultado de la PS muestra pansensibilidad debe pasar al esquema 1. Si no se logra disponer de la PS, el tratamiento puede extenderse a 24 meses o más.
Retratamiento estandarizado
para TB MDR
El esquema comprende: 2- 4 Km Lfx Z E Eto Cs/ Km2-3 Lfx Z E Eto Cs/Lfx Z E Eto Cs
[2 a 4 meses de Kanamicina + Levofloxacina + Pirazinamida + Ethambutol + Etionamida + Cicloserina (todos diario); seguido de Kanamicina 2 a 3 veces por semana + Levofloxacina + Pirazinamida + Ethambutol + Etionamida + Cicloserina (todos diario); seguido de Levofloxacina + Pirazinamida + Ethambutol + Etionamida + Cicloserina (todos diario)] .
Está indicado en pacientes con sospecha de TB MDR, y cuya PS está en proceso; en los siguientes casos: i) Paciente que fracasó al Esquema 1, demostrado por cultivo positivo al 4º mes de tratamiento; ii) Paciente con TB activa y antecedente de dos tratamientos previos completos y que cuenta con cultivo positivo; ó en iii) Paciente en Esquema 1 en muy mal estado clínico y con sospecha de TB MDR.
El esquema debe ser modificado al recibirse el resultado de la PS, pasándose así a un esquema individualizado. Si el resultado de la PS muestra pansensibidad debe ser pasado a esquema 1. Si no se logra disponer de la PS, el tratamiento puede extenderse a 24 meses o más.
Esquemas para TB resistente
no MDR
Estas recomendaciones se aplican cuando las PS, muestran perfiles de resistencias no muy amplias (mono o polirresistencias), requiriéndose esquemas menos complejos y por menor tiempo (Tabla 3).
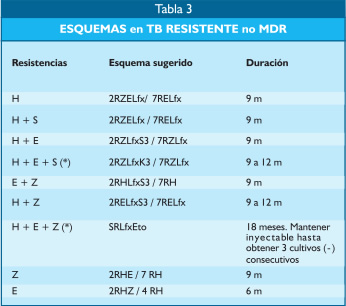 |
(*) Si la PS se conoce al terminar la 1ra fase o en el transcurso de la 2da fase
solicitar evaluación del CERN y UT TB MDR.
Adaptado de Actualización del sub numeral 7. Tratamiento de la
tuberculosis de la NTS N° 041-MINSA/DGSP-V.01. Incluyendo la
incorporación de Levofloxacina (Lfx) en reemplazo de Ciprofloxacina. |
Retratamiento para TB XDR
En todos los casos son tratamientos individualizados, requiriéndose drogas EV de elevado costo y/o medicamentos aún bajo estudios, solicitados para su uso compasivo. La decisión de dicho esquema la realiza el CERN.
Problemas pendientes en el tratamiento
de la TB MDR y TB XDR
- En lugares de elevada incidencia de TB XDR, un esquema empírico determinado por una prueba rápida, estaría modificándose a un esquema individualizado (a las 18 semanas). En estos escenarios, podría ser aconsejable el uso de BACTEC para drogas de 1ra y 2da línea, a fin de decidir el mejor esquema, lo más precoz posible.
- Retraso en el inicio de retratamientos TB MDR, por dificultades en conocer los resultados procedentes del laboratorio, completar los expedientes, etc. Situación operativa compleja, que va mejorando progresivamente.
- Elevada tasa de abandonos a los esquemas de retra tamiento (16%). Estos abandonos, al no curarse están favoreciendo la transmisión en la comunidad, y en segundo lugar, por haber suspendido una o más veces el tratamiento, es posible que hayan ampliado su resistencia a mayor número de antimicrobianos: la génesis de la TB XDR.
- Necesidad de Nuevas drogas: La industria y la ciencia, no han ido paralelos al problema, se ha extendido la resistencia, pero no han aparecido nuevas drogas, por lo que los esquemas son menos eficientes frente a un mayor espectro de resistencia.
Es claro, que el fracaso a un esquema terapéutico en TB, obliga a usar al menos tres drogas efectivas en el nuevo esquema. Entonces, ¿qué hacer frente a pacientes que están fracasando a esquemas de TB MDR?. Necesitamos "varias" nuevas drogas en corto tiempo. En la actualidad, hay dos drogas en estudio de Fase III que muestran ser eficaces: Delamanid (OPC-67683) y Bedaquiline (TMC207 ó R207910), ambas en estudio en nuestro país.
Control y perspectivas futuras
- Los resultados de las intervenciones para el Control de la TB y sus formas resistentes hasta la fecha son pobres, por lo que necesitan ser reevaluados.
- Se requiere una vigilancia epidemiológica que incida en los aspectos sociales, que permitan generar nuevas estrategias de intervención considerando "los determinantes sociales".
- Un enfoque intenso sobre poblaciones vulnerables en riesgo de TB, que a la vez constituyen el mayor riesgo de abandono de sus tratamientos TB (Personas sin hogar, usuarios de drogas, alcohólicos, personas que recientemente recuperan su libertad, etc), necesita ser implementado.
- El uso de albergues o casa de aislamiento, para pacientes con cepas resistentes y problemas de adherencia, debieran validarse, garantizando la eficacia de sus servicios y en especial las adecuadas medidas de control de infecciones en TB (bioseguridad).
Conclusiones
- El M. tuberculosis está profundamente adaptado al ser humano, ya que es su reservorio.
- La resistencia es un fenómeno natural de defensa de los microorganismos, que si bien es controlable, es un fenómeno inevitable.
- El diagnóstico y tratamiento de los casos, ayuda en la cura del individuo, sin embargo este enfoque, no es suficiente para el control de la endemia tuberculosa en la comunidad
.- En la actualidad no disponemos de medicamentos ni de vacunas eficientes, que garanticen el control de la TB en la comunidad en mediano plazo.
- La generación de cepas con mayor perfil de resistencia, y su amplia extensión hacia la comunidad se está dando a nivel mundial, lo que incluye a nuestro país.
- Las medidas de control de infecciones en TB en los hospitales han mostrado ser eficientes, en escenarios de TB sensible o resistente.
- Es urgente disponer de medidas de control de infecciones en TB en la comunidad, tarea que debe de asumirla la sociedad en su conjunto.
- Ahora, necesitamos hacer esfuerzos intensos en garantizar el diagnóstico y tratamiento precoz, así como de la "adherencia total" a los diferentes esquemas de tratamiento TB.
Referencias Bibliográficas
- Streptomycin treatment of pulmonary tuberculosis. British medical journal. 1948;2(4582):769-82. Epub 1948/10/30.
- Treatment of pulmonary tuberculosis with streptomycin and para-aminosalicylic acid; a Medical Research Council investigation. British medical journal. 1950;2(4688):1073-85. Epub 1950/11/11.
- Fox W, Sutherland I. A five-year assessment of patients in a controlled trial of streptomycin, para-aminosalicylic acid, and streptomycin plus para-aminosalicylic acid, in pulmonary tuberculosis. The Quarterly journal of medicine. 1956;25(98):221-43. Epub 1956/04/01.
- Caminero JA. Guia de la tuberculosis para médicos especialistas. Unión Internacional contra la tuberculosis y enfermedades respiratorias. París, 2003.
- Tuberculosis Programme: Framework for effective tuberculosis control. Geneva: World Health Organization; 1994.
- Global DOTS expansion plan: progress in TB control in high-burden countries. Geneva: 2001 Contract No.: WHO/CDS/STB/2001.11.
- Gupta R, Cegielski JP, Espinal MA, Henkens M, Kim JY, Lambregts-Van Weezenbeek CS, et al. Increasing transparency in partnerships for health--introducing the Green Light Committee. Tropical medicine & international health. 2002;7(11):970-6. Epub 2002/10/23.
- Shah NS, Wright A, Bai GH, Barrera L, Boulahbal F, Martin-Casabona N, et al. Worldwide emergence of extensively drug-resistant tuberculosis. Emerging infectious diseases. 2007;13(3):380-7. Epub 2007/06/08.
- Multidrug and extensively drug-resistant TB (M/XDR-TB): 2010 global report on surveillance and response. Geneva: World Health Organization, 2010.
- Dalton T, Cegielski P, Akksilp S, Asencios L, Caoili JC, Cho SN, et al. Prevalence of and risk factors for resistance to second-line drugs in people with multidrug-resistant tuberculosis in eight countries: a prospective cohort study. Lancet. 2012. Epub 2012/09/04.
- The Stop TB Strategy. Geneva: World Health Organization; 2006.
- The Global Plan to Stop TB 2011 - 2015. Geneva: World Health Organization; 2011.
- Ticona E. Tuberculosis: ¿se agotó el enfoque biomédico? Rev Peru Med Exp Salud Pública. 2009;26(3):273 - 275.
- Registro Médico Electrónico Julio 2012. ESNPCTB, DGSP, Ministerio de Salud - Perú, 2012.
- Kwan CK, Ernst JD. HIV and tuberculosis: a deadly human syndemic. Clinical microbiology reviews. 2011;24(2):351-376. Epub 2011/04/13.
- Wells CD, Cegielski JP, Nelson LJ, Laserson KF, Holtz TH, Finlay A, et al. HIV infection and multidrug-resistant tuberculosis: the perfect storm. The Journal of infectious diseases. 2007;196 Suppl 1:S86-107. Epub 2007/08/30.
- Basu S, Galvani AP. The transmission and control of XDR TB in South Africa: an operations research and mathematical modelling approach. Epidemiology and infection. 2008;136(12):1585-1598. Epub 2008/07/09.
- Abdool Karim SS, Churchyard GJ, Abdool Karim Q, Lawn SD. HIV infection and tuberculosis in South Africa: an urgent need to escalate the public health response. Lancet. 2009;374(9693):921-933. Epub 2009/08/28.
- Zignol M, van Gemert W, Falzon D, Sismanidis C, Glaziou P, Floyd K, et al. Surveillance of anti-tuberculosis drug resistance in the world: an updated analysis, 2007-2010. Bulletin of the World Health Organization. 2012;90(2):111-9D. Epub 2012/03/17.
- Campos PE, Suárez PG, Sánchez J, Zavala D, Arévalo J, Ticona E, et al. Multidrug-resistant Mycobacterium tuberculosis in HIV-infected persons, Peru. Emerging infectious diseases. 2003;9(12):1571-8. Epub 2004/01/15.
- Nosocomial transmission of multidrug-resistant tuberculosis to health-care workers and HIV-infected patients in an urban hospital--Florida. MMWR Morbidity and mortality weekly report. 1990;39(40):718-22. Epub 1990/10/12.
- Valway SE, Greifinger RB, Papania M, Kilburn JO, Woodley C, DiFerdinando GT, et al. Multidrug-resistant tuberculosis in the New York State prison system, 1990-1991. The Journal of infectious diseases. 1994;170(1):151-156. Epub 1994/07/01.
- Gandhi NR, Moll A, Sturm AW, Pawinski R, Govender T, Lalloo U, et al. Extensively drug-resistant tuberculosis as a cause of death in patients co-infected with tuberculosis and HIV in a rural area of South Africa. Lancet. 2006;368(9547):1575-80. Epub 2006/11/07.
- Gillespie SH. Evolution of drug resistance in Mycobacterium tuberculosis: clinical and molecular perspective. Antimicrobial agents and chemotherapy. 2002;46(2):267-74. Epub 2002/01/18.
- Actualización del sub numeral 7. Tratamiento de la tuberculosis de la NTS N° 041-MINSA/DGSP-V.01 Norma tecnica de salud para el control de la tuberculosis 2006. Ministerio de Salud - Perú; 2010.
- Registro electrónico codificado de expedientes evaluados en el CERI, Semestre I - 2012. ESRPCT, DISA VLC, Ministerio de Salud - Perú, 2012.
- Drobniewski F, Nikolayevskyy V, Balabanova Y, Bang D, Papaventsis D. Diagnosis of tuberculosis and drug resistance: what can new tools bring us? The international journal of tuberculosis and lung disease: the official journal of the International Union against Tuberculosis and Lung Disease. 2012;16(7):860-870. Epub 2012/06/13.
- Chien HP, Yu MC, Wu MH, Lin TP, Luh KT. Comparison of the BACTEC MGIT 960 with Lowenstein-Jensen medium for recovery of mycobacteria from clinical specimens. The international journal of tuberculosis and lung disease. 2000;4(9):866-870. Epub 2000/09/14.
- Moore DA, Evans CA, Gilman RH, Caviedes L, Coronel J, Vivar A, et al. Microscopic-observation drug-susceptibility assay for the diagnosis of TB. The New England journal of medicine. 2006;355(15):1539-1550. Epub 2006/10/13.
- Hillemann D, Rusch-Gerdes S, Richter E. Evaluation of the GenoType MTBDRplus assay for rifampin and isoniazid susceptibility testing of Mycobacterium tuberculosis strains and clinical specimens. Journal of clinical microbiology. 2007;45(8):2635-2640. Epub 2007/06/01.
- Boehme CC, Nabeta P, Hillemann D, Nicol MP, Shenai S, Krapp F, et al. Rapid molecular detection of tuberculosis and rifampin resistance. The New England journal of medicine. 2010;363(11):1005-1015. Epub 2010/09/10.
- Asencios L, Galarza M, Quispe N, Vasquez L, Leo E, Valencia E, et al. Molecular test Genotype(R) MTBDRplus, an alternative to rapid detection of multidrug resistance tuberculosis. Rev Peru Med Exp Salud Publica. 2012;29(1):92-98. Epub 2012/04/19.
- Gandhi NR, Andrews JR, Brust JC, Montreuil R, Weissman D, Heo M, et al. Risk factors for mortality among MDR- and XDR-TB patients in a high HIV prevalence setting. The international journal of tuberculosis and lung disease. 2012;16(1):90-97. Epub 2012/01/13.
1. Médico Infectólogo, Hospital Nacional Dos de Mayo. Universidad de San Martín de Porres (USMP). Universidad Nacional Mayor de San Marcos (UNMSM). |
