INFECCIONES EMERGENTES Y REMERGENTES
PRIMERA PARTE
Infecciones por el virus de la Influenza
Victor Alberto Laguna-Torres, MD. MTMH. PhD.
Introducción
El virus de la influenza tiene la particularidad de afectar al tracto respiratorio de los humanos ocasionando una infección aguda altamente contagiosa que puede autolimitarse o de lo contrario ocasionar epidemias o pandemias de alto impacto para la salud pública. La influenza se presenta como epidemias locales o regionales anuales a la que se denomina influenza estacional (1). Asimismo, interactúa con bacterias causando sinergismos, provoca complicaciones no solo respiratorias sino en varios aparatos y sistemas del organismo humano y aunque generalmente provoca cuadros leves e inocuos, los mismos pueden provocar incapacidad temporal del individuo afectado debido a las características de los síntomas respiratorios que hacen muy difícil desenvolverse con normalidad durante uno o dos días. Esto puede, frecuentemente, ocasionar ausentismo escolar y laboral.
Este virus tiene la particularidad de presentar cambios en el genoma con frecuencia, lo que determina una variación antigénica (1). Anualmente, estos cambios de estructura hacen con que no exista capacidad de reconocerlo inmunológicamente y la población expuesta esté nuevamente en riesgo de infectarse.
El virus puede ser del Tipo A, B y C. Siendo las características morfológicas de ellos similares (2).
La inestabilidad genética de este virus da lugar a la aparición de pandemias las cuales se han caracterizado por un aumento de la morbilidad y mortalidad. En el siglo XX, la llamada "Gripe Española" (1918-1919) fue la primera. En Perú, se calcula que el índice de mortalidad en Iquitos fue tan alto como 2.9% mayor que en Lima (1.6%) (3). La siguiente, se inició en 1957, al norte de China y rápidamente se diseminó a todo el mundo. Finalmente en 1968, denominada como "La Gripe Asiática", se extendió rápidamente por todo el mundo, con alta morbilidad, pero menor letalidad que las anteriores.
En el siglo XXI una nueva variante apareció y fue llamada "Swine Flu", después se le denominó A/H1N1 pandémica y hay varias siglas que han sido usadas en las publicaciones para su denominación. Fue producto de un cambio genético mayor y se presentaron gran número de casos que se diseminaron por varios continentes ocasionando la primera pandemia de este siglo. Esta se caracterizó por ser no tan agresiva como inicialmente se pensaba y la evolución de las comunicaciones sirvió para diseminarla pero también para conseguir rápidamente información de lo que iba ocurriendo en otras latitudes, en el caso de Perú, aprendimos mucho de lo que pasaba en México y su experiencia llegaba casi en tiempo real a nosotros, lo que sirvió para estar preparados (4).
Fisiopatología
La inestabilidad genética que poseen hace que fácilmente puedan eludir la respuesta inmune del huésped mediante cambios en sus genes que se traduce en cambios en los antígenos de superficie. Modificaciones genómicas menores llamadas "antigenic drift" ocurren en los virus de influenza A y afectan a la hemaglutinina (H) y la neuraminidasa (N) al modifcarse algunos aminoácidos. Suceden frecuentemente y resultan en la aparición de nuevas cepas en un mismo subtipo. El intercambio genético entre diferentes virus de humanos y animales produce un cambio mayor. Este es llamado "salto antigénico" (antigenic shift) y resulta en la aparición de un distinto virus con nuevas proteínas de superficie, hemaglutinina (H) y neuraminidasa (N).
Esta capacidad de adaptación que poseen los virus de la influenza para eludir las defensas del huésped explicaría los ciclos endémicos, epidémicos y pandémicos que se suceden en el tiempo.
Este virus se transmite por la vía aérea, a través de los estornudos las secreciones respiratorias expelidas entran en contacto con utensilios, ropa o superficies que pueden contaminarse. El virus al superar los mecanismos de defensa del epitelio respiratorio, puede penetrar hasta las células epiteliales por endocitosis (5.6) y producir la infección que puede llevar a complicaciones en grupos de riesgo como niños, ancianos y pacientes con enfermedades cardiopulmonares previas. El virus de la influenza interacciona con bacterias patógenas respiratorias tales como Streptococcus pneumoniae y potencian el daño que ocasionan al parénquima pulmonar (6,7,8). Existe evidencia de un sinergismo letal entre el virus de influenza y los patógenos bacterianos que pueden ser responsables del exceso de mortalidad durante la epidemia y pandemia de influenza (7,9). Asimismo, pueden aparecer complicaciones cardíacas (10), neurológicas (11) y otros problemas severos como mioglobinuria (12), síndrome de Reye (13,14) miositis (15) y síndrome del choque tóxico (16) . En el 2009, con la llegada de la cepa pandémica se describieron también complicaciones pulmonares, neurológicas y cardíacas, entre otras (17,18,19).
La neumonía es una complicación entre los niños y el curso puede ser severo, especialmente entre los 6 meses y 4 años y los que tienen asma (20).
Aspectos epidemiológicos
La vigilancia centinela de influenza y otros virus respiratorios en el Perú ha demostrado que el virus de influenza circula todo el año en el país, pero ciertas características se han evidenciado por regiones. El virus de influenza A ha predominado en la mayoría de los años entre el 2006 y 2009, salvo brotes específicos de influenza B en unidades militares. (21). En la región norte (Tumbes, Piura) y selva se evidenció circulación viral en todo el año, y hay una tendencia a la estacionalidad en la región andina del sur del país (Arequipa, Cusco y Puno) donde se evidencia circulación principalmente en la época que empieza la temporada fría que es entre abril y julio. Los subtipos de influenza estacional A (H1N1) y A (H3N2) son predominantes en todos los grupos de edad (22). Figura 1 (Tomado y modificado de Plos One Laguna et al. (22)). En los menores de 5 años y más evidente en los menores de 1 año, circulan en una mayor proporción otros virus respiratorios como virus sincitial respiratorio (RSV), adenovirus y parainfluenza.
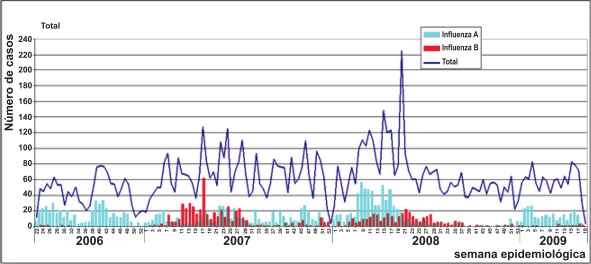 |
| Figura 1. Distribución temporal por semana epidemiológica de casos confirmados de influenza A y B. Perú Jun 2006- May 2009. Tomado y modificado de Plos One (22). |
En la figura 1 vemos como hasta mayo del 2009 la circulación del virus de influenza A era predominante en el país.
En Perú, se evaluaron los resultados de 1400 cultivos antes y después de la llegada de la cepa pandémica. Después del 9 de mayo del 2009 cuando aparece la cepa pandémica, el virus de influenza A (H1N1) pdm 2009, fue el predominante en todos los grupos de edad desplazando a los otros subtipos estacionales (23). Figura 2 (Tomado de Plos One Laguna et al (23)). Después de la semana epidemiológica 24 del año 2009, la cepa pandémica desplaza a la cepa estacional del virus tipo A y mantiene esa preponderancia por todo el año. Figura 3
(Tomado y modificado de Plos One Laguna et al. (23)).
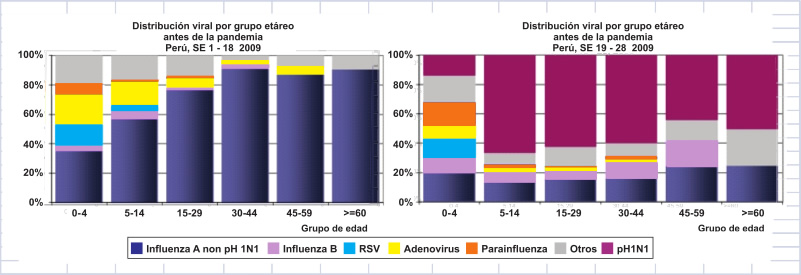 |
| Figura 2. Tomado y modificado de Plos One (23). |
 |
| Figura 3. Distribución viral por semana epidemiológica, antes y después de la pandemia. Perú 2009. |
El virus se expandió rápidamente con una distribución casi igual entre hombres y mujeres siendo los más afectados los del grupo etáreo de 5 a 14 años de edad. Al parecer los primeros casos se diseminaron a partir de escolares que viajaron a Punta Cana, República Dominicana de donde aproximadamente una docena volvieron con síntomas respiratorios (24). El número de casos secundarios que se presentan después de un caso, se denomina índice de reproducción y su símbolo es R0. Durante la pandemia del 2009, en Perú, este índice se estimó entre 1.6-2.2 para Lima metropolitana y 1.3-1.5 para el resto del Perú (24,25).
Asimismo durante la pandemia, mientras que en Lima, Arequipa y Trujillo circulaba ya el virus pandémico, en el área de selva (Iquitos) los casos no se presentaban y circulaba predominantemente el virus de tipo B Figura 4 (Tomado y modificado de Plos One Laguna et al. (23)).
En el 2010 y 2011, de
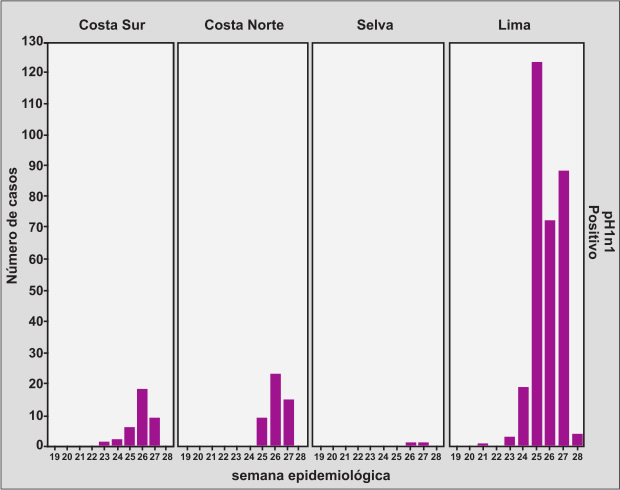 |
| Figura 4. Distribución viral de influenza A pH1N1 por regiones y por semana epidemiológica durante la pandemia.
Perú SE (19-28). Tomado y modificado de Pos One (23). |
spués de la pandemia, nuevamente circula virus de influenza A pero esta vez con predominancia del tipo A (H3N2) estacional y con una mínima circulación del virus pandémico A (H1N1) pdm 2009 y permaneciendo casi ausente el A (H1N1) estacional (Figura 5).
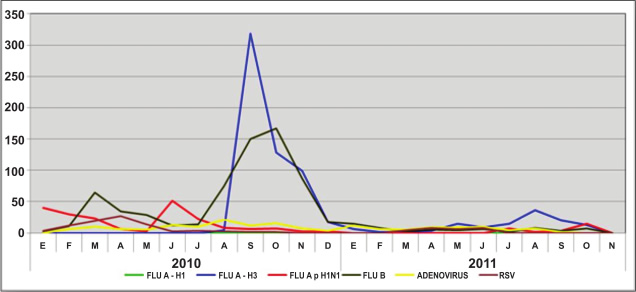 |
| Figura 5. Distribución viral mensual de los subtipos de virus de influenza y otros virus. Perú 2010 -2011. |
Asimismo en nuestro país no se había identificado la mutación que confiere resistencia a los inhibidores de la neuroaminidasa (oseltamivir) (26) pero en julio del 2012, NAMRU-6 lo encontró por primera vez en una muestra procedente de Puno, Perú (42).
La transmisión de la influenza durante la pandemia, afectó principalmente a niños y adultos jóvenes, pero se evidenció que los grupos de mayor edad tuvieron mayores tasas de mortalidad y letalidad. La mayoría de las veces las muertes estuvieron relacionadas con la presencia de otras enfermedades de base (comorbilidad) o con la presencia de factores de riesgo.
Diagnóstico
El virus se puede detectar por medio del cultivo celular y para eso se emplean hasta cuatro líneas celulares: MDCK, VERO E6 ,VERO 76, LLMCK2. Asimismo se puede detectar el virus por medio de PCR convencional o el rt-PCR (en tiempo real) siendo que durante la pandemia el diagnóstico fue exclusivo con primers específicos que se diseminaron desde el CDC en EEUU. También se puede realizar inmunofluorescencia.
Medidas de prevención y control
Las medidas de prevención en esta infección son eficaces y pueden controlar la diseminación viral. Intervenciones combinadas para disminuir la transmisión han mostrado gran eficacia y durante la última pandemia del 2009 han servido enormemente.
Medidas no farmacéuticas: Son eficaces para la mitigación de la pandemia y en períodos interpandémicos.
• Aislamiento de los casos: Si evitamos que un paciente con influenza circule, la cantidad de contactos disminuirá. Una profesora enferma, un cocinero o un chofer de servicio público que están estornudando y tosiendo al público que atiende, será mejor tenerlos en casa. Durante la vigilancia centinela, antes de la pandemia, utilizamos una prueba rápida de 94% de especficidad que brinda el beneficio al paciente de recibir descanso médico reduciendo la circulación del paciente y se evita, además, el uso indebido de antibióticos (22). Durante la pandemia del 2009, el aislamiento de casos, cuarentena, fue controversial (27), pero en lo referente al cierre de los colegios para disminuir la circulación, en Perú, la medida fue eficaz reduciendo la transmisión (22,25). En México llegó un momento en que la asistencia a los restaurantes, cines y la circulación en vehículos de servicio público estuvo casi totalmente abolida. En una pandemia, la búsqueda de febriles y sintomáticos en aeropuertos es una medida muy relativa y controversial. No parece tener eficacia técnica mas puede tener un efecto político. Puede servir para detectar los primeros casos que llegan al país (27,28).
• El lavado de manos asiduo con o sin agregado de antisépticos (29,30). Sin lugar a dudas, es una medida eficaz. Asimismo, evitar toser en la mano al cubrirse la boca, haciéndolo en la flexura del brazo evitará la diseminación de secreciones al dar la mano a otra persona.
• Medidas de barrera como guantes, batas, y máscaras con mecanismo de filtración: Este es el aislamiento adecuado. El uso de las máscaras es realmente de ayuda para la prevención. En los hospitales las máscaras simples "quirúrgicas" se deben utilizar para evitar la transmisión. El personal expuesto a aerosoles, como por ejemplo quien aspira a un paciente infectado en la unidad de cuidados intensivos, debe usar la máscara con mecanismo de filtración llamado N95. En las casas el uso de máscaras ha probado prevenir la transmisión sobre todo cuando se usan dentro de las 36 horas de iniciados los síntomas (31).
Medidas farmacéuticas
• Tratamiento antiviral: Existen cinco agentes virales para el tratamiento de la infección por influenza. De ellos cuatro ya están aprobados para el uso farmacológico: La amantadina, la rimantadina y los llamados inhibidores de la neuraminidasa: el oseltamivir y el zanamivir. Los antivirales pueden mitigar la severidad de la infección reducir la duración de la enfermedad y las complicaciones asociadas. El tratamiento instituido tempranamente es más efectivo (32). El virus 2009 H1N1 es susceptible a oseltamivir, zanamivir usados durante la pandemia reduciendo el número de complicaciones y muertes (33). Antes de la pandemia del 2009 difícilmente se encontraba algún clínico en Perú que hubiese usado antivirales para tratar una infección por influenza. No había experiencia en el tema y además, no se encontraban disponibles en el Perú, especialmente los inhibidores de la neuraminidasa.
1. Adamantanes: La amantadina o rimantadina: Tiene acción solo contra el subtipo A. Fármacos de administración oral y que se indicaba a 5mg/kg de peso por día c/12 hrs para los niños de 1 a 9 años de edad y 100 mg al día c/12 hrs cuando el niño tiene más de 45 kgs. por dos a cinco días. Estos fármacos no tienen actualmente uso en esta infección debido a la presencia de resistencia (34) detectada en 95.5% de los aislamientos A/H3N2, inclusive en Perú (35).
2. Inhibidores de neuraminidasa: oseltamivir y zanamivir: Tienen acción contra ambos subtipos A y B. Oseltamivir está recomendado en niños de ≥ 1 año de edad y Zanamivir ≥ en 7años (32). Durante la pandemia se autorizó el uso en menores de un año a 3mg/Kg/dosis una vez al día basándose en experiencias previas (36).
El oseltamivir puede reducir significativamente la duración de la enfermedad en 1.25 a 1.5 días, en niños (37,38). En estudios randomizados de adultos [39,40] se ha demostrado que el tto con antivirales dentro de las 48 horas de iniciados los síntomas reduciendo la enfermedad en 1 a 2 días. Si se detecta la mutacion H275Y se debe cambiar oseltamivir por zanamivir (2), por ahora esa mutación se ha detectado en solo una muestra proveniente de Puno, Perú (42).
Existen dos fármacos para uso endovenoso: peramivir y zanamivir. Actualmente se encuentran en investigación en ensayos clínicos (32).
• Vacunación
Actualmente la vacuna se basa en antígenos HA derivados de viriones desnaturalizados o virus vivos atenuados inactivos. Debido a la variación anual se hace una formulación nueva cada año. Presenta problemas logísticos puesto que debe prepararse a partir de huevos embrionados y cuando la producción comenzó ya no puede haber modificación.
Asimismo la vacuna se basa en una selección de cepas circulantes, que se recogen durante el año previo y de acuerdo al patrón que estudia el comité que se reúne al final de cada año en Europa, se decide cual será la fórmula para la vacuna del siguiente año. La vacuna constará siempre de tres componentes, las cepa A/H1N1, la cepa A/H3N2 y el subtipo B. La formulación se hace para el hemisferio norte y para el hemisferio sur. Puede ocurrir que la vacuna que está en uso en un año determinado, no cubra a alguna de las cepas que están circulando en ese período de tiempo, como ocurrió en algunos años en Perú (22). Muchas veces alguna de las tres cepas que se incluyeron en las vacunas de un año específico no protegieron a la población que, estuvo expuesta a una cepa diferente a la de la formulación de la vacuna. Sin embargo, eso no significa que se deba proscribir la vacunación. La vacuna protege a la gran mayoría de la población y brinda un gran beneficio a la salud pública, especialmente a las poblaciones vulnerables.
Por otro lado, se busca tener vacunas que puedan proteger mucho más que solo un año y por eso se han iniciado estudios con la llamada Vacuna recombinante Influenza (M2eflagellin (41). Ella se basa en la premisa que el Antígeno M2e no es variable en humanos y se expresa en la membrana de células infectadas. Así la vacuna que actualmente está en FASE I de investigación, consigue producir niveles altos de anticuerpos contra el antígeno M2e y protegen contra la enfermedad reduciendo la replicación viral. La fase I en 60 sujetos adultos, demostró respuesta inmune adecuada.
El año siguiente a la pandemia, el 2010, se utilizo en Perú una vacuna monovalente con la cepa adecuada para cubrir a la población. Después de eso se volvió a usar la cepa trivalente.
En el primer trimestre de este año 2013 se notificó un nuevo virus de influenza aviar A (H7N9) a partir de genes de diferentes aves. En China se han reportado una centena de casos humanos con una tasa de letalidad superior al 20,0%. Aún no se conoce la fuente de infección y no se ha encontrado nexo epidemiológico entre los casos y hasta la primera quincena de mayo del 2013 no se tiene evidencia de transmisión sostenida de humano a humano.
Con certeza, estamos frente a un nuevo episodio de esta infección viral que en mayo del 2009 apareció en nuestro país con una "cepa pandémica" y que aproximadamente cuatro años después presenta una nueva variación que tiene en zozobra al mundo científico.
Conclusión
La infección por el virus de la influenza puede producir un cuadro simple con malestar general o por otro lado puede impedir el normal desenvolvimiento de las actividades de una persona produciendo ausentismo laboral o escolar y puede llegar a causar complicaciones médicas tan graves que merezcan el ingreso a unidades de cuidados intensivos o la muerte.
Queda claro que las medidas de prevención y control son efectivas y debemos hacer el esfuerzo de implementarlas.
Descargo de responsabilidad y derechos de autor: Las opiniones y afirmaciones contenidas aquí son propias del autor y no deben interpretarse como posición oficial o que reflejan la opinión del servicio naval de los Estados Unidos o ninguna agencia del gobierno. El presente trabajo no está protegido por leyes de derechos de autor, ya que constituye contribución del gobierno de los Estados Unidos. Financiamiento: La participación de NAMRU-6 fue financiada por el Sistema de Vigilancia y Respuesta de Defensa Global de Infecciones Emergentes (DoD-GEIS), unidad de trabajo (Work Unit No. 847705 82000 25GB B0016) dentro del estudio NMRCD.2002.0019 aprobado por el Comité de Ética del NAMRU-6 de acuerdo a todas las regulaciones federales que protegen a los sujetos humanos.
Referencias Bibliográficas
-
Cox NJ, Subbarao K. Influenza. Lancet 1999;354:1277-1282.
-
Stamboulian D, Bonvehi PE, Nacinovich FM, Cox N. Influenza. Infect Dis Clin North Am 2000;14:141-166.
-
Chowell G, Viboud C, Simonsen L, Miller MA, Hurtado J, et al. The 1918-1920 influenza pandemic in Peru. Vaccine 2011;29 Suppl 2: B21-26.
-
Laguna-Torres VA, Benavides JG. Infection and death from influenza A H1N1 virus in Mexico. Lancet 2009;374: 2032-2033.
-
Cross KJ, Burleigh LM, Steinhauer DA. Mechanisms of cell entry by influenza virus. Expert Rev Mol Med 2001;3:1-18.
-
Schwarzmann SW, Adler JL, Sullivan RJ, Jr., Marine WM. Bacterial pneumonia during the Hong Kong influenza epidemic of 1968-1969. Arch Intern Med 1971;127:1037-1041.
-
McCullers JA, Bartmess KC. Role of neuraminidase in rlethal synergism between influenza virus and Streptococcus pneumoniae.
J Infect Dis 2003;187:1000-1009.
- McCullers JA. Insights into the interaction between influenza virus and pneumococcus. Clinical microbiology reviews 2006;19:571-582.
- Madhi SA, Klugman KP. A role for Streptococcus pneumoniae in virus-associated pneumonia. Nat Med 2004;10:811-813.
- Rezkalla SH, Kloner RA. Influenza-related viral myocarditis. WMJ: official publication of the State Medical Society of Wisconsin 2010;109:209-213.
- Amin R, Ford-Jones E, Richardson SE, MacGregor D, Tellier R, et al. Acute childhood encephalitis and encephalopathy associated with influenza: a prospective 11-year review. The Pediatric infectious disease journal 2008;27:390-395.
- Minow RA, Gorbach S, Johnson BL, Jr., Dornfeld L. Myoglobinuria associated with influenza A infection. Annals of internal medicine 1974;80:359-361.
- Halsey NA, Hurwitz ES, Meiklejohn G, Todd WA, Edell T, et al. An epidemic of Reye syndrome associated with influenza A (H1N1) in Colorado. The Journal of pediatrics 1980;97:535-539.
- Morens DM, Noble GR. Reye syndrome and influenza. Lancet 1977;1:807-808.
- Dietzman DE, Schaller JG, Ray CG, Reed ME. Acute myositis associated with influenza B infection. Pediatrics 1976;57:255-258.
- Sperber SJ, Francis JB. Toxic shock syndrome during an influenza outbreak. JAMA 1987;257:1086-1087.
- Bratincsak A, El-Said HG, Bradley JS, Shayan K, Grossfeld PD, et al. Fulminant myocarditis associated with pandemic H1N1 influenza A virus in children. J Am Coll Cardiol 2010;55:928-929.
- Ekstrand JJ, Herbener A, Rawlings J, Turney B, Ampofo K, et al. Heightened neurologic complications in children with pandemic H1N1 influenza. Ann Neurol 2010;68:762-766.
- Louie JK, Gavali S, Acosta M, Samuel MC, Winter K, et al. Children hospitalized with 2009 novel influenza A(H1N1) in California. Arch Pediatr Adolesc Med 2010;164:1023-1031.
- Dawood FS, Fiore A, Kamimoto L, Nowell M, Reingold A, et al. Influenza-associated pneumonia in children hospitalized with laboratory-confirmed influenza, 2003-2008. The Pediatric infectious disease journal 2010;29:585-590.
- Saldarriaga T, Laguna-Torres VA, Arrasco J, Guillén L, Aguila J, Aguilar PV, Sovero M, Pérez J, Ríos J, Gamero M, González R, Kochel T. Características clínicas y moleculares de un brote de influenza en dos bases militares, Tumbes- Perú, 2007. Rev Peru Med Exp Salud Publica 2008;25:35-43.
- Laguna-Torres VA, Gómez J, Ocana V, Aguilar P, Saldarriaga T, et al. Influenza-like illness sentinel surveillance in Peru. PLoS One 2009;4:e6118.
- Laguna-Torres VA, Gomez J, Aguilar PV, Ampuero JS, Munayco C, et al. Changes in the viral distribution pattern after the appearance of the novel influenza A H1N1 (pH1N1) virus in influenza-like illness patients in Peru. PLoS One 2010;5:e11719.
- Munayco CV, Gómez J, Laguna-Torres VA, Arrasco J, Kochel TJ, et al. Epidemiological and transmissibility analysis of influenza A(H1N1)v in a southern hemisphere setting: Peru. Euro Surveill 14. 2009.
- Chowell G, Viboud C, Munayco CV, Gómez J, Simonsen L, et al. Spatial and temporal characteristics of the 2009 A/H1N1 influenza pandemic in Peru. PLoS One 2011;6:e21287.
- Sovero M, García J, Laguna-Torres VA, Gómez J, Aleman W, et al. Genetic analysis of influenza A/H1N1 of swine origin virus (SOIV) circulating in Central and South America. Am J Trop Med Hyg 2010;83:708-710.
- Chu CY, Li CY, Zhang H, Wang Y, Huo DH, et al. Quarantine methods and prevention of secondary outbreak of pandemic (H1N1) 2009. Emerging infectious diseases 2010;16:1300-1302.
- Fujita M, Sato H, Kaku K, Tokuno S, Kanatani Y, et al. Airport quarantine inspection, follow-up observation, and the prevention of pandemic influenza. Aviation, space, and environmental medicine 2011;82:782-789.
- Simmerman JM, Suntarattiwong P, Levy J, Jarman RG, Kaewchana S, et al. Findings from a household randomized controlled trial of hand washing and face masks to reduce influenza transmission in Bangkok, Thailand. Influenza and other respiratory viruses 2011;5:256-267.
- Summaries for patients. The effects of hand washing and facemasks on prevention of influenza infection. Annals of internal medicine 2009;151:1-18.
- Cowling BJ, Chan KH, Fang VJ, Cheng CK, Fung RO, et al. Facemasks and hand hygiene to prevent influenza transmission in households: a cluster randomized trial. Annals of internal medicine 2009;151:437-446.
- Garg S, Fry AM, Patton M, Fiore AE, Finelli L. Antiviral treatment of influenza in children. The Pediatric infectious disease journal 2012;31:e43-51.
- Uyeki T. Antiviral treatment for patients hospitalized with 2009 pandemic influenza A (H1N1). N Engl J Med 2009;361:e110.
- Bright RA, Shay DK, Shu B, Cox NJ, Klimov AI. Adamantane resistance among influenza A viruses isolated early during the 2005-2006 influenza season in the United States. JAMA 2006;295:891-894.
- Garcia J, Sovero M, Laguna-Torres VA, Gomez J, Douce R, et al. Antiviral resistance in influenza viruses circulating in Central and South America based on the detection of established genetic markers. Influenza and other respiratory viruses 2009;3:69-74.
- Kimberlin DW, Shalabi M, Abzug MJ, Lang D, Jacobs RF, et al. Safety of oseltamivir compared with the adamantanes in children less than 12 months of age. The Pediatric infectious disease journal 2010;29:195-198.
- Heinonen S, Silvennoinen H, Lehtinen P, Vainionpaa R, Vahlberg T, et al. Early oseltamivir treatment of influenza in children 1-3 years of age: a randomized controlled trial. Clin Infect Dis 2010;51:887-894.
- Whitley RJ, Hayden FG, Reisinger KS, Young N, Dutkowski R, et al. Oral oseltamivir treatment of influenza in children. The Pediatric infectious disease journal 2001;20:127-133.
- Nicholson KG, Aoki FY, Osterhaus AD, Trottier S, Carewicz O, et al. Efficacy and safety of oseltamivir in treatment of acute influenza: a randomised controlled trial. Neuraminidase Inhibitor Flu Treatment Investigator Group. Lancet 2000;355:1845-1850.
- Treanor JJ, Hayden FG, Vrooman PS, Barbarash R, Bettis R, et al. Efficacy and safety of the oral neuraminidase inhibitor oseltamivir in treating acute influenza: a randomized controlled trial. US Oral Neuraminidase Study Group. JAMA 2000;283:1016-1024.
- Turley CB, Rupp RE, Johnson C, Taylor DN, Wolfson J, et al. Safety and immunogenicity of a recombinant M2e-flagellin influenza vaccine (STF2.4xM2e) in healthy adults. Vaccine 2011;29:5145-5152.
- Garcia J, Felices V, Gomez J, Gomez E, Laguna-Torres VA. [Detection of an influenza a (H1N1) pdm09 strain resistant to Oseltamivir in Peru]. Rev Peru Med Exp Salud Publica. 2013;30(1):157-158.
1Médico Infectólogo, Universidad Nacional Mayor de San Marcos (UNMSM), Lima-Perú. Magíster en Enfermedades Infecciosas y parasitarias. Universidad de Brasilia, Brasilia, Brasil. Doctor en Medicina Tropical, Universidad Federal del Triángulo Mineiro, Uberaba, Brasil.. Sub Director del Departamento de Virología del Centro de Investigación de Enfermedades Tropicales, NAMRU-6, Lima, Perú.
|
